Kaloriméter-előzmények, alkatrészek, típusok és jellemzőik
az hőmennyiségmérő olyan eszköz, amely az adott fajlagos hővel rendelkező anyag (általában víz) mennyiségének hőmérséklet-változásának mérésére szolgál. Ez a hőmérsékletváltozás a vizsgált folyamatban abszorbeált vagy felszabaduló hőnek köszönhető; vegyi anyag, ha reakció, vagy fizikai, ha egy fázisból vagy állapotváltozásból áll.
A laboratóriumban a legegyszerűbb kalóriamérő a kávéscsésze. A reakciót állandó nyomáson, vizes oldatban felvett vagy felszabaduló hő mérésére használják. A reakciókat úgy választjuk meg, hogy elkerüljük a reagensek vagy a gáz halmazállapotú termékek beavatkozását.
 Exoterm reakcióban a kibocsátott hőmennyiség a kaloriméter és a vizes oldat hőmérsékletének növekedése alapján számítható ki:
Exoterm reakcióban a kibocsátott hőmennyiség a kaloriméter és a vizes oldat hőmérsékletének növekedése alapján számítható ki:
A reakció során felszabaduló hőmennyiség = a kaloriméter által elnyelt hőmennyiség + az oldat által elnyelt hőmennyiség
A kaloriméter által elnyelt hőmennyiséget kaloriméter-kalória-kapacitásnak nevezzük. Ezt úgy határozzuk meg, hogy ismert mennyiségű vizet adunk egy adott vízmennyiséggel. Ezután megmérjük a kaloriméter hőmérsékletét és a benne lévő oldatot.
Ezekkel az adatokkal és a víz fajlagos hőjének (4,18 J / g ° C) használatával kiszámítható a kaloriméter kalória-kapacitása. Ezt a kapacitást állandóan kaloriméternek is nevezik.
Másrészről a vizes oldat által nyert hőmérséklet egyenlő m · ce · Δt-vel. A képletben m = a víz tömege, ce = a fajlagos vízhőmérséklet és Δt = a hőmérséklet változása. Mindezek ismeretében kiszámítható az exoterm reakció által kibocsátott hőmennyiség.
index
- 1 A kaloriméter története
- 2 rész
- 3 Típusok és jellemzőik
- 3.1 A kávéscsésze
- 3.2 A kalorimetriás szivattyú
- 3.3 Az adiabatikus kaloriméter
- 3.4 Az izoperiboláris kaloriméter
- 3.5 Az áramlási kaloriméter
- 3.6 A kaloriméter a differenciális szkennelési kalorimetriához
- 4 Alkalmazások
- 4.1 Fizikai-kémia
- 4.2 Biológiai rendszerekben
- 4.3 Az oxigénszivattyú és a kalóriaerő kalorimétere
- 5 Referenciák
A kaloriméter története
1780-ban A. L. Lavoisier, a francia kémikus, aki a kémia egyik apjának tekintette, tengerimalacot használt, hogy megmérje a hőtermelését a lélegeztetésével..
Hogyan? A kaloriméterhez hasonló eszköz használata. A tengerimalac által termelt hőt a készülék körülvett hó olvadása bizonyította.
A. Lavoisier (1743-1794) és P. S. Laplace (1749-1827) kutatói egy olyan kalorimétert terveztek, amely a test egyedi hőjének mérésére szolgál a jég olvadási módszerével..
A kaloriméter egy ónozott, hengeres főzőpohárból állt, lakkozott, állvány által tartott, és belsejében egy tölcsérrel végződött. Belül egy másik pohár került elhelyezésre, hasonlóan az előzőhöz, egy csővel, amely átment a külső kamrán, és egy kulcsot kapott. A második üveg belsejében rács volt.
Ebben a rácsban a lényeget vagy tárgyat helyeztük el, amelynek meghatározott hőt kívánunk meghatározni. A jég a koncentrikus edényekbe került, mint a kosárban.
A test által termelt hőt a jég abszorbeálta, ami fúzióját okozza. A jég olvadása folyékony víztermékét összegyűjtöttük, és megnyitottuk a belső üveg kulcsát.
És végül, a víz mérésével ismert volt az olvadt jég tömege.
alkatrészek
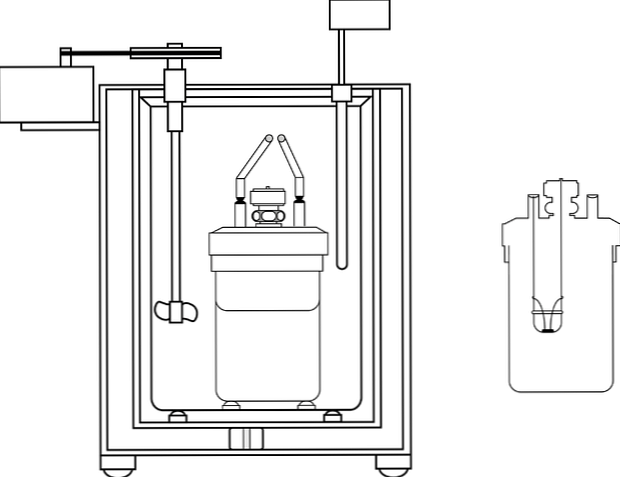
A kémia tanító laboratóriumokban a leggyakrabban használt kaloriméter az úgynevezett kávéscsésze kaloriméter. Ez a kaloriméter egy főzőpohárból áll, vagyis anime anyagból készült tartályból, amely bizonyos szigetelő tulajdonságokkal rendelkezik. A tartály belsejében a vizes oldatot a testbe helyezik, amely hőt termel vagy elnyel.
A tartály felső részén két lyukú szigetelőanyag fedele van. Az egyikben hőmérőt vezetünk be a hőmérséklet-változások mérésére, a másikban keverőt, előnyösen üveganyagot, amely a vizes oldat tartalmának mozgatását végzi..
A kép egy kalorimetrikus szivattyú részeit mutatja; azonban megfigyelhető, hogy a hőmérővel és a keverővel közös elemei több kaloriméterben vannak.
Típusok és jellemzőik
A kávéscsésze
Ez az egyik, amelyet az exoterm reakció által kibocsátott hő meghatározására használnak, és az endoterm reakcióban felszívódó hőt..
Ezenkívül használható egy test sajátos hőjének meghatározására; azaz a hőmennyiség, amelyet egy anyag grammjának abszorbeálnia kell ahhoz, hogy a hőmérsékletet egy Celsius fokmal emelje. .
A kalorimetrikus szivattyú
Olyan eszköz, amelyben az állandó térfogatban fellépő reakcióban felszabaduló vagy abszorbeált hőmennyiséget mérjük.
A reakció egy erős acéledényben (a szivattyúban) történik, amely nagy mennyiségű vízbe merül. Ezáltal a vízhőmérséklet változása kicsi. Ezért feltételezzük, hogy a reakcióhoz kapcsolódó változásokat állandó hőmérsékleten és térfogatban mérjük.
A fentiek azt jelzik, hogy nem végeznek munkát, ha a reakciót kalorimetriás szivattyúban hajtjuk végre.
A reakció a szivattyúhoz csatlakoztatott kábelek áramellátásával kezdődik.
Az adiabatikus kaloriméter
Jellemzője, hogy egy szigetelőszerkezet, amelyet pajzsnak nevezünk. A pajzs a sejt körül helyezkedik el, ahol a hő és a hőmérséklet változik. A hőátadás elkerülése érdekében elektronikus rendszerhez is csatlakozik, amely hőmérséklete nagyon közel áll a cellához.
Adiabatikus kaloriméterben a kaloriméter és a környezete közötti hőmérsékletkülönbség minimális; valamint a hőátadási együttható és a hőcserélő idő minimalizálása.
Részei a következőkből állnak:
-A cellát (vagy tartályt) olyan szigetelő rendszerbe integrálták, amellyel megpróbálják elkerülni a hőveszteséget.
-A hőmérő a hőmérséklet változások mérésére szolgál.
-A szabályozható elektromos feszültségforráshoz csatlakoztatott fűtés.
-És a pajzs már említett.
Az ilyen típusú kaloriméterekben meghatározhatók olyan tulajdonságok, mint az entrópia, a Debye hőmérséklet és az elektronikus állapot sűrűsége.
Az izoperibolikus kaloriméter
Olyan eszköz, amelyben a reakciósejt és a szivattyú egy olyan burkolatba van merítve, amelyet kabátnak neveznek. Ebben az esetben az úgynevezett kabát vízből áll, állandó hőmérsékleten tartva.
A cella és a szivattyú hőmérséklete emelkedik, amikor az égési folyamat során hő keletkezik; de a vízköpeny hőmérsékletét állandó hőmérsékleten tartjuk.
A mikroprocesszor szabályozza a cella és a köpeny hőmérsékletét, a szükséges hőmérséklet-korrekciókat a két hőmérséklet közötti különbségekből eredően..
Ezeket a korrekciókat folyamatosan és végleges korrekcióval alkalmazzák a vizsgálat előtt és után elvégzett mérések alapján.
Az áramlási kaloriméter
A Caliendar által kifejlesztett készüléknek van egy eszköze a gáz egy tartályban állandó sebességgel mozgatására. Hő hozzáadásakor megmérjük a folyadék hőmérsékletének növekedését.
Az áramlási kalorimétert a következők jellemzik:
- Az állandó áramlási sebesség pontos mérése.
- A melegítőn keresztül a folyadékba bevezetett hőmennyiség pontos mérése.
- Az energiabevitel által okozott gáz hőmérséklet-emelkedésének pontos mérése
- A nyomás alatt lévő gáz kapacitásának mérésére szolgáló kialakítás.
A differenciális szkennelési kalorimetria kalorimétere
Jellemzője, hogy két tárolóedény van: egyben a vizsgálandó mintát helyezzük el, míg a másik üres, vagy egy referenciaanyagot használunk..
A két edényt állandó energiasebességgel, két független fűtőberendezéssel melegítik. Amikor a két konténer fűtése megkezdődik, a számítógép grafikusan ábrázolja a fűtőberendezések hőáramlásának különbségét a hőmérséklettel, így meghatározhatja a hőáramlást.
Ezenkívül meghatározható a hőmérséklet függvényében bekövetkező változás is; és végül a kalória-kapacitás.
alkalmazások
A fizikai-kémia
-Az alap kaloriméterek, a kávéscsészék típusai lehetővé teszik a test által kibocsátott vagy felszívódó hő mennyiségének mérését. Meghatározhatják, hogy a reakció exoterm vagy endoterm. Ezenkívül meghatározható a test sajátos hője is.
-Az adiabatikus kaloriméterrel meg lehetett határozni egy kémiai folyamat entrópiáját és az állam elektronikus sűrűségét.
A biológiai rendszerekben
-A mikrokalorimétereket olyan biológiai rendszerek tanulmányozására használják, amelyek magukban foglalják a molekulák közötti kölcsönhatásokat, valamint az előforduló molekuláris konformációs változásokat; például egy molekula kibontakozásában. A vonal mind a differenciál szkennelést, mind az izoterm titrálást tartalmazza.
-A mikrokalorimétert kis molekulák, bioterápiás szerek és vakcinák gyógyszereinek kifejlesztésére használják.
Oxigénszivattyú kaloriméter és kalóriaerő
Számos anyag égése az oxigénszivattyú kaloriméterében történik, és kalória-teljesítménye meghatározható. A kaloriméter használatával vizsgált anyagok közül a szén és a koksz; étkezési olajok, mind nehéz, mind könnyű; benzin és minden motorüzemanyag.
A repülőgép-reaktorok üzemanyag-típusai mellett; üzemanyag-hulladék és a hulladék ártalmatlanítása; Élelmiszerek és kiegészítők az emberi táplálkozáshoz; takarmánynövények és takarmány-kiegészítők; építőanyagok; rakéta- és hajtóanyag-üzemanyagok.
Hasonlóképpen, a kalóriatartalmat az éghető anyagok termodinamikai vizsgálatában kalorimetriával határozták meg; az ökológia egyensúlyának tanulmányozásában; robbanóanyagokban és hőporokban, valamint az alapvető termodinamikai módszerek oktatásában.
referenciák
- Whitten, Davis, Peck és Stanley. Kémia. (8. kiadás). CENGAGE Tanulás.
- González J., Cortés L. és Sánchez A. (s.f.). Adiabatikus kalorimetria és alkalmazásai. Visszanyerve: cenam.mx
- Wikipedia. (2018). Kaloriméter. Lap forrása: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (2018. június 22.). Kaloriméter meghatározása a kémia területén. A lap eredeti címe: thinkco.com
- Gillespie, Claire. (2018. április 11.). Hogyan működik a kaloriméter? Sciencing. A lap eredeti címe: sciencing.com


