Kémiai aktiválási energia Mit tartalmaz, számítás
az kémiai aktiválási energia (a kinetikai vizsgálatok szempontjából) a kémiai reakció megkezdéséhez szükséges legkisebb energiamennyiségre utal. A kémiai kinetikában tapasztalható ütközések elmélete szerint elmondható, hogy minden mozgó molekula bizonyos mennyiségű kinetikus energiával rendelkezik..
Ez azt jelenti, hogy minél nagyobb a mozgás sebessége, annál nagyobb a kinetikus energiája. Ebben az értelemben egy gyors mozgást hordozó molekula önmagában nem osztható fel töredékekre, így ütközésnek kell lennie közöttük és egy másik molekulában, hogy kémiai reakció léphessen fel..
Amikor ez megtörténik - amikor a molekulák között ütközés következik be, a kinetikus energiájának egy töredéke vibrációs energiává alakul át. Hasonlóképpen, ha a folyamat elején a kinetikus energia magas, az ütközésben részt vevő molekulák olyan nagy rezgést mutatnak, hogy a jelen lévő kémiai kötések egy része megtört..
A kapcsolatok ilyen törése az első lépés a reagensek termékké történő átalakításában; vagyis ezek kialakulásában. Másrészt, ha ennek a folyamatnak a kezdetén a kinetikus energia kis mértékű, akkor a molekulák „visszapattanása” jelenség lesz, amelyen keresztül gyakorlatilag sértetlenek lesznek..
index
- 1 Mit tartalmaz ez??
- 1.1 Aktivált komplex
- 2 Hogyan számítják ki?
- 2.1 Kémiai reakció aktiválási energiájának kiszámítása
- 3 Hogyan befolyásolja az aktiválási energia a reakció sebességét?
- 4 Példák az aktiválási energia kiszámítására
- 5 Referenciák
Mit tartalmaz ez??
A molekulák közötti ütközések koncepciójától kezdve a korábban leírt kémiai reakciók megindításához elmondható, hogy az ütközés előfordulásához szükséges minimális mennyiségű energia szükséges..
Tehát, ha az energiaérték kisebb, mint ez a szükséges minimum, akkor az ütközés után egyszerűen nem lesz változás a molekulák között, ami azt jelenti, hogy amikor ez az energia hiányzik, az érintett fajok gyakorlatilag sértetlenek és nem fognak megtörténni bármilyen változás a sokk miatt.
Az ötletek e sorrendjében a minimális energiát, amely a molekulák közötti ütközés után bekövetkezett változáshoz szükséges, aktivációs energiának nevezzük.
Más szavakkal, a sokkban részt vevő molekuláknak olyan kinetikus energiájúnak kell lenniük, amelynek nagysága megegyezik az aktiválási energiával vagy nagyobb azzal, hogy kémiai reakció léphessen fel..
Továbbá sok esetben a molekulák ütköznek és egy új faj, az aktivált komplexnek neveznek, melyet "átmeneti állapotnak" is neveznek, mert csak ideiglenesen létezik.
Ezt az ütközés és a reakciótermékek képződése következtében keletkező reaktánsok okozzák.
Aktivált komplexum
A fent említett aktivált komplex egy nagyon alacsony stabilitású fajt alkot, amely viszont nagy mennyiségű potenciális energiával rendelkezik.
A következő ábra a reaktánsok termékké alakított energiaátalakulását mutatja, és megjegyzi, hogy az aktivált komplex energiájának nagysága lényegesen nagyobb, mint a reagensek és termékeké..
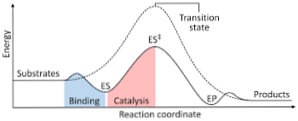
Ha a reakció végén a termékek nagyobb stabilitással rendelkeznek, mint a reaktánsok, az energia felszabadulása hő formájában történik, ami exoterm reakciót eredményez..
Éppen ellenkezőleg, ha a reagensek nagyobb mennyiségű stabilitást eredményeznek, mint a termékek, akkor azt jelenti, hogy a reakcióelegy az energia felszívódását mutatja a környezetéből származó hő formájában, ami endoterm reakciót eredményez..
Hasonlóképpen, ha egy eset vagy a másik előfordul, egy olyan diagramot kell kialakítani, mint amilyet a korábban bemutatott, ahol a rendszer haladási energiája, amely a reakció előrehaladásával vagy folyamatával reagál, ábrázolásra kerül..
Ily módon a reakció bekövetkezésekor bekövetkező lehetséges energiaváltozások keletkeznek, és a reagensek termékké alakulnak.
Hogyan számítják ki?
A kémiai reakció aktiválási energiája szorosan kapcsolódik a reakció sebességének állandójához, és ennek az állandónak a hőmérséklethez való függését az Arrhenius egyenlet mutatja:
k = Ae-Ea / RT
Ebben a kifejezésben k a reakció sebességének állandóját jelenti (amely a hőmérséklettől függ) és a paramétert A frekvencia-faktornak nevezik, és ez a molekulák közötti ütközések gyakoriságának mértéke.
A maga részéről, és a természetes logaritmusok sorozatát fejezi ki. Ez az aktiválási energia negatív hányadosával megegyező teljesítményre emelkedik (ea) a gázállandóságból származó termék között (R) és az abszolút hőmérsékletet (T).
Meg kell jegyezni, hogy a frekvenciatényező bizonyos reakciórendszerekben széles hőmérséklet-tartományban állandónak tekinthető.
Ezt a matematikai kifejezést eredetileg a holland származású kémikus Jacobus Henricus van't Hoff állította 1884-ben, de aki tudományos érvényességet adott és értelmezte a svéd született kémikus, Svante Arrhenius, 1889-ben..
Egy kémiai reakció aktiválási energiájának kiszámítása
Az Arrhenius egyenlet rámutat arra, hogy a reakció sebességének állandója és a molekulák közötti összecsapások gyakorisága között van közvetlen arányosság..
Továbbá, ez az egyenlet a természetes logaritmusok tulajdonságának az egyenlet mindkét oldalára történő alkalmazásával könnyebben ábrázolható:
ln k = ln A - Ea / RT
A feltételek egyenletének (y = mx + b) megszerzése érdekében a kifejezések átrendezése során a következő kifejezést érjük el:
ln k = (- Ea / R) (1 / T) + ln A
Tehát, ha egy ln k és 1 / T függvény grafikonját állítjuk elő, egyenes vonalat kapunk, ahol ln k az y koordinátát jelenti, (- A / R) a vonal meredekségét (m), (1 / T) az x koordinátát jelöli, és ln A az ordináták (b) tengelyével való metszéspontot jelenti..
Amint látható, az e számításból eredő lejtés megegyezik a -Ea / R értékével. Ez azt jelenti, hogy ha az aktiválási energia értékét ezen kifejezéssel kívánjuk elérni, egyszerű tisztítást kell végezni, ami a következőket eredményezi:
Ea = -mR
Itt tudjuk, hogy az m és R értéke 8,314 J / K · mol egyenlet.
Hogyan befolyásolja az aktiválási energia a reakció sebességét?
Az aktiválási energia képének megpróbálásakor olyan akadálynak tekinthető, amely nem teszi lehetővé az alacsonyabb energiájú molekulák közötti reakció bekövetkeztét..
Ahogy egy közös reakcióban is előfordul, hogy a reagálható molekulák száma meglehetősen nagy, ezeknek a molekuláknak a sebessége - és ezzel egyenértékű - kinetikus energiája is nagyon változó lehet..
Általában előfordul, hogy a molekulák összességéből csak kis mennyiségben tapasztalható az ütközés - amelyek nagyobb sebességgel rendelkeznek - elég kinetikus energiával rendelkeznek ahhoz, hogy képes legyen leküzdeni az aktiválási energia nagyságát. Tehát ezek a molekulák alkalmasak és képesek a reakció része.
Az Arrhenius egyenlet szerint az aktiválási energia és az abszolút hőmérséklettel a gázállandóság terméke közötti hányadot megelőző negatív jel azt jelenti, hogy a sebesség konstans csökken, mivel az aktiválási energia megnő, valamint a hőmérséklet növekedésével járó növekedés.
Példák az aktiválási energia kiszámítására
Az Arrhenius-egyenlet szerint az aktivációs energia grafikon segítségével történő kiszámításához azt kell megállapítani, hogy az acetaldehid bomlási reakciójának sebességtartományait öt különböző hőmérsékleten mértük, és meg kívánjuk határozni az aktiválási energiát. a reakcióhoz:
CH3CHO (g) → CH4(g) + CO (g)
Az öt mérés adatai a következők:
k (1 / M1/2S): 0,011 - 0,035 - 0,105-0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Először az ismeretlen megoldásához és az aktiválási energia meghatározásához meg kell építeni egy ln k vs 1 / T (y vs x) gráfot, hogy egyenes vonalat kapjunk, és innen vegyük le a lejtőt és keressük meg az Ea értékét. a magyarázat szerint.
A mérések adatainak átalakítása az Arrhenius egyenlet szerint [ln k = (- Ea / R) (1 / T) + ln A] az alábbi értékek találhatók az y és x értékekre:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Ezekből az értékekből és a lejtő matematikai kiszámításával - számítógépen vagy számológépben - az m = (Y2-és1) / (X2-X1) vagy lineáris regressziós módszer alkalmazásával kapjuk meg, hogy m = -Ea / R = -2,09 * 104 K. Tehát:
Ea = (8,314 J / K · mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 102 kJ / mol
Ahhoz, hogy grafikus úton meghatározzuk az aktiválás más energiáit, hasonló eljárást hajtunk végre.
referenciák
- Wikipedia. (N.d.). Aktiválási energia. A (z) en.wikipedia.org webhelyről származik
- Chang, R. (2007). Kémia, kilencedik kiadás. Mexikó: McGraw-Hill.
- Britannica, E. (s.f.). Aktiválási energia. A britannica.com-ból származik
- Moore, J. W. és Pearson, R. G. (1961). Kinetika és mechanizmus. A következőt kapta: books.google.co.ve
- Kaesche, H. (2003). Fémek korróziója: fizikai-kémiai elvek és aktuális problémák. A következőt kapta: books.google.co.ve


