Magnézium-hidrid formula, kémiai szerkezet és tulajdonságok
az magnézium-hidrid (MGH2 molekuláris képlet), egy kémiai vegyület, amelynek hidrogéntartalma 7,66%, és a természetben fehér kristályos szilárd anyagként található. Elsősorban más kémiai anyagok előállítására használják, bár a hidrogén potenciális tárolóközegeként is vizsgálták.
Ez a sóoldat (vagy ionos) hidridek családjához tartozik, amely negatív töltésű H-ion által definiált. Ezeket a hidrideket úgy tekintjük, mint amelyek alkálifémekből és alkáliföldfémekből képződnek, de a magnézium (és a berillium) esetében kovalens kötésekkel rendelkeznek a hidridcsaládot jellemző ionok mellett..
index
- 1 Előkészítés és képlet
- 2 Kémiai szerkezet
- 3 Fizikai és kémiai tulajdonságok
- 3.1 Fizikai
- 3.2 Vegyi anyagok
- 4 Felhasználások
- 4.1 Hidrogén tárolás
- 4.2 A hidrogénezés és a dehidrogén reakciói
- 4.3 Sár
- 4.4 Üzemanyagcellák
- 4.5 Közlekedés és energia
- 4.6 Alkilezés
- 5 Kockázatok
- 5.1 Vízzel való reakció
- 5.2 Piroforikus
- 6 Referenciák
Előkészítés és képlet
A magnézium-hidridet magnézium (Mg) fém közvetlen hidrogénezésével, magas nyomáson és hőmérsékleten (200 ° C, 500 ° C), MgI-katalizátorral képezzük.2. Reakciója egyenértékű:
Mg + H2→ MgH2
A MgH termelését is vizsgálták2 alacsonyabb hőmérsékleten, golyósmalmokban előállított nanokristályos magnézium alkalmazásával.
Vannak más előállítási módszerek is, de összetettebb kémiai reakciókat képviselnek (magnézium-antracén hidrogénezése, dietil-magnézium és lítium-alumínium-hidrid reakciója, valamint MgH-komplex terméke).2).
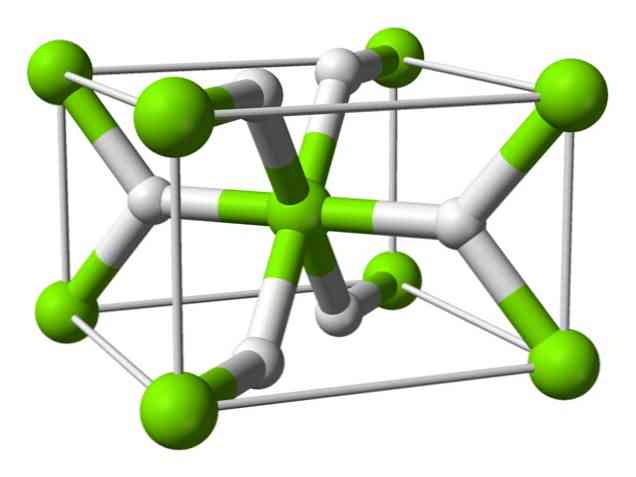
Kémiai szerkezet
Ez az atom szobahőmérsékleten rutil szerkezetű, tetragonális kristályszerkezettel. Magas nyomású körülmények között legalább négy különböző formája van, és nem sztöchiometrikus, hidrogénhiányos szerkezetet is megfigyeltek; ez utóbbi csak nagyon kis mennyiségű részecskéknél fordul elő, amikor kialakul.
Amint fentebb említettük, a rutilszerkezetben létező kötések részben kovalens tulajdonságokkal rendelkeznek, nem pedig tisztán ionosak, mint a többi sóhidrid..
Ez azt eredményezi, hogy a magnézium-atom gömb alakú, teljesen ionizált, de hidridionja hosszúkás szerkezetű.
Fizikai és kémiai tulajdonságok
fizikai
- Megjelenés: Fehér kristályok.
- Molekulatömeg: 26,3209 g / mol
- Sűrűség: 1,45 g / cm3
- Olvadáspont: 285 ° C bomlik
- Oldhatóság: vízben bomlik.
Ez a kémiai vegyület molekulatömege 26,321 g / mol, sűrűsége 1,45 g / cm3, és az olvadáspontja 327 ° C..
vegyi
- Elővegyület egyéb vegyi anyagok előállításához.
- Hidrogén tárolás, mint lehetséges energiaforrás.
- Redukálószer szerves szintézisben.
Fontos jelezni, hogy ez a vegyület nem hozható folyékony állapotba, és ha azt hordjuk vagy olvadáspontja vagy vízbe juttatjuk, akkor bomlik. Ez a hidrid éterben nem oldódik.
Rendkívül reaktív és gyúlékony anyag, és piroforikus is, azaz spontán gyulladhat a levegőben. Ez a három feltétel olyan biztonsági kockázatokat jelent, amelyek a cikk utolsó szakaszában szerepelnek.
alkalmazások
Hidrogén tárolás
A magnézium-hidrid könnyen reagál vízzel, hogy hidrogéngázt képezzen a következő kémiai reakció segítségével:
MGH2+2H2O → 2H2+Mg (OH)2
Ezenkívül ez az anyag 287 ° C hőmérsékleten és 1 bar nyomáson bomlik, az alábbiak szerint:
MGH2→ Mg + H2
Ezért javasolt a magnézium-hidrid felhasználása hidrogén tárolóközegként a felhasználás és a szállítás során.
A fém-magnézium mennyiségének hidrogénezését és dehidrogénezését javasolják a gáz halmazállapotú hidrogén mennyiségének szállítására, ezáltal biztosítva, hogy a szállítás során nincs szivárgás, és biztonságosabb és praktikusabb, mint a nagynyomású edények használata..
Hidrogénezési és dehidrogénezési reakciók
Bár a magnézium-hidrid bomlási hőmérséklete korlátozó tényezőt jelent a használatához, a hidrogénezés és a dehidrogénezési reakciók kinetikájának javítására javasolt módszerek. Ezek közül az egyik a magnézium-részecskék méretének csökkentése golyósmalmok használatával.
sár
Ezenkívül olyan rendszert javasoltak, amely mágneses hidridet képez sár formájában (jobban kezelhető és biztonságosabb, mint a por vagy más szilárd részecskéké), amelyet vízzel reagáltatunk a kívánt hidrogén előállítása érdekében..
Becslések szerint a korábban nevezett iszapot egy finomra őrölt hidrid képezi, amely olajos védőréteggel van védve, és diszpergálószerben szuszpendálva biztosítja, hogy anyagának elvesztése nélkül megtartsa konzisztenciáját, és hogy nem szívja fel a nedvességet a környezetből..
Ennek az iszapnak az az előnye, hogy bármely szokásos dízel-, benzin- vagy vízszivattyún keresztül szivattyúzható, így ez a gazdasági javaslat hatékony és hatékony..
Üzemanyagcellák
A magnézium-hidrid a fejlett üzemanyagcellák gyártásában, valamint az akkumulátorok és az energiatároló létrehozásában is megvalósítható.
Szállítás és energia
Az elmúlt évtizedekben figyelembe vették a hidrogén mint energiaforrás használatát. A hidrogén üzemanyagként történő beültetése biztonságos és reverzibilis tárolórendszereket és nagy térfogatú kapacitásokat (hidrogén mennyiséget térfogatra vonatkoztatva) és gravimetriát (hidrogén mennyiséget tömegegységre vonatkoztatva) talál..
alkilezési
Alkilezés (CH-alkilcsoportok hozzáadása3R) szerves vegyületek bázikus tápközegben, ahol alacsony koncentrációban és magasabb hőmérsékleten magasabb -OH csoportok vannak jelen, mint a hidrid olvadáspontja..
Ebben az esetben a magnézium-hidridben jelenlévő hidrogének (MgH2), a vizet képező -OH csoportokat összekeverjük. A szabad magnézium a halogénatomot kapja, amely gyakran a szénhidrogénlánchoz kötődő alkil-molekulával együtt jár.
kockázatok
Reakció vízzel
Mint már említettük, a magnézium-hidrid olyan anyag, amely nagyon könnyen és hevesen reagál vízzel, és nagyobb koncentrációban képes felrobbanni.
Ez azért következik be, mert exoterm reakciója elegendő hőt termel a bomlási reakcióban felszabaduló hidrogéngáz meggyulladásához, ami elég veszélyes láncreakcióhoz vezet..
Piroforikus
A magnézium-hidrid piroforos is, ami azt jelenti, hogy nedves levegő jelenlétében spontán gyulladhat, és magnézium-oxidot és vizet képez..
Belélegzése nem ajánlott szilárd állapotban vagy gőzzel érintkezve: az anyag természetes állapotában és bomlástermékei súlyos sérüléseket vagy akár halált okozhatnak.
Korróziós oldatokat hozhat létre vízzel érintkezve és szennyeződéssel. A bőrrel és a szemmel való érintkezés nem ajánlott, és irritációt is okoz a nyálkahártyákban.
Nem bizonyították, hogy a magnézium-hidrid olyan krónikus egészségügyi hatásokat okozhat, mint a rák, a reproduktív hibák vagy más fizikai vagy mentális következmények, de a kezelés során (különösen a légzőkészülékeket vagy maszkokat, védőeszközöket) ajánlott a védőfelszerelés használata. finom por karakter).
Ha ezzel az anyaggal dolgozunk, a levegő nedvességtartalmát alacsony szinten kell tartani, az összes gyújtóforrást el kell oltani, és hordókban vagy más tartálykonténerekben szállítani..
Mindig kerülje el az anyag nagy koncentrációját, ha elkerülhető, mivel a robbanás lehetősége jelentősen csökken.
Ha a magnézium-hidrid kiömlődik, a munkaterületet el kell különíteni és a port porszívóval kell összegyűjteni. Soha ne használjon száraz seprési eljárást; növeli a hidriddel való reakció valószínűségét.
referenciák
- Zumdahl, S. S. (1998). Encyclopedia Britannica. A britannica.com-ból.
- Pubchem. (2005). PubChem nyílt kémiai adatbázis. A pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Zöld autó kongresszus. Készült a greencarcongress.com oldalról.
- Vegyszerek, C. (n.d.). Cameo Chemicals. Takeochemicals.noaa.gov.
- Services, N. J. (1987). New Jersey Egészségügyi és Senior Szolgáltatások Tanszék. Az nj.gov.


