Boyle-Mariotte története, matematikai kifejezés, példák
A törvény a Boyle ez az, amely kifejezi a gáz által kifejtett nyomás vagy az általuk elfoglalt térfogat közötti kapcsolatot; a gáz hőmérsékletének állandó megtartása, valamint annak mennyisége (molok száma).
Ez a törvény Charles, Gay-Lussac, Charles és Avogadro együttesével egy ideális gáz viselkedését írja le; kifejezetten egy zárt tartályban, amely mechanikai erő által kifejtett térfogat-változásoknak van kitéve.
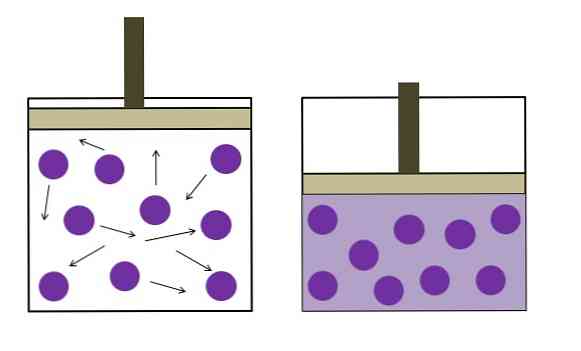
A fenti képen röviden összefoglaljuk a Boyle-Mariotte törvényt.
A lila pontok olyan molekulákat vagy gázatomokat jelentenek, amelyek ütköznek a tartály belső falával (balra). Az e gáz által elfoglalt tartály rendelkezésre álló helyének vagy térfogatának csökkentésével az ütközések növekednek, ami a nyomás növekedéséhez vezet (jobbra).
Ez azt mutatja, hogy a gáz P nyomása és V térfogata fordítottan arányos, ha a tartály hermetikusan lezárt; ellenkező esetben a nagyobb nyomás egyenlő lenne a tartály nagyobb kiterjedésével.
Ha egy V ábrát P ellen irányítottunk, az Y és X tengelyeken V és P adatokkal, aszimptotikus görbe figyelhető meg. Minél kisebb a V, annál nagyobb a P növekedése; vagyis a görbe az X tengelyen lévő P magas értékére terjed ki.
Természetesen a hőmérséklet állandó marad; de ha ugyanazt a kísérletet különböző hőmérsékleteken hajtottuk végre, akkor a V és P görbék relatív pozíciói a Dartes-tengelyben változnak. A változás még nyilvánvalóbb lenne, ha egy háromdimenziós tengelyen ábrázolnánk, ahol a konstans T a Z tengelyen.
index
- 1 Boyle törvénye
- 1.1 Háttér
- 1.2 Kísérletezzen higanyval
- 1.3 Edme Mariotte
- 1.4 A jog megerősítése
- 2 Mit tartalmaz ez a törvény??
- 3 Matematikai kifejezés
- 4 Mi az? Milyen problémákat old meg Boyle törvénye??
- 4.1 Gőzgépek
- 4.2 Sip italok
- 4.3 Légzőrendszer
- 5 Példák (kísérletek)
- 5.1 1. kísérlet
- 5.2 2. kísérlet
- 6 Referenciák
Boyle törvénye
háttér
Mivel Galileo Galilei tudós kifejezte az üresség létezésének meggyőződését (1638), a tudósok elkezdték tanulmányozni a levegő és a részleges üregek tulajdonságait..
Robert Boyle, az angol-ír kémikus 1638-ban kezdte meg tanulmányait a levegő tulajdonságairól, amikor megtudta, hogy Otto von Guericke, egy német mérnök és fizikus épített egy légszivattyút.
Kísérletezzen a higanyval
A levegőnyomás tanulmányozásához Boyle egy üvegcsövet használt, "J" alakban, amelynek építését Robert Hooke, a Boyle asszisztense adja. A rövid kar végét lezártuk, míg a cső hosszú karjának vége nyitott volt a higany elhelyezéséhez.
A kezdetektől fogva Boyle a levegő rugalmasságát minőségi és mennyiségi szempontból kívánta tanulmányozni. A higany öntésével a "J" alakú cső nyitott végén keresztül Boyle arra a következtetésre jutott, hogy a cső rövid karjában lévő levegő higanynyomás alá esett..
találatok
Minél nagyobb a higany hozzáadott mennyisége a csőhöz, annál nagyobb a nyomás a levegőre, és annál kisebb a térfogata. Boyle negatív exponenciális típusú grafikonot kapott a levegő térfogatának függvényében a nyomás függvényében.
Míg ha a levegő térfogatát a nyomás ellentétes irányába vetíti, akkor egyenes vonal van a pozitív lejtőn.
1662-ben Boyle közzétette az első fizikai törvényt, amelyet egyenlet formájában adtak meg, ami két változó funkcionális függőségét jelezte. Ebben az esetben a nyomás és a térfogat.
Boyle rámutatott, hogy fordított kapcsolat áll fenn a gázra kifejtett nyomás és a gáz által elfoglalt térfogat között, ez az arány viszonylag igaz a valódi gázok esetében. A legtöbb gáz úgy viselkedik, mint az ideális gázok mérsékelt nyomáson és hőmérsékleten.
Magasabb nyomás és alacsonyabb hőmérséklet mellett az eszmék valódi gázainak viselkedésétől való eltérések érzékelhetőbbé váltak.
Edme Mariotte
A francia fizikus, Ediot Mariotte (1620-1684) 1679-ben önállóan fedezte fel ugyanazt a törvényt. Ezért nevezik Mariotte törvényének vagy Boyle és Mariotte törvényének.
A törvény megerősítése
Daniel Bernoulli (1737) megerősítette Boyle törvényét, rámutatva, hogy a gáz nyomását a tartály falára ható gázrészecskék hatása befolyásolja..
1845-ben John Waterston közzétett egy tudományos cikket, amelyben a gázok kinetikai elméletének fő elveire összpontosít.
Később Rudolf Clausius, James Maxwell és Ludqwig Boltzmann konszolidálták a gázok kinetikai elméletét, amely a gáz által kifejtett nyomást a mozgó gáz részecskéinek sebességével kapcsolja össze..
Minél kisebb a gáz tartalmú tartály térfogata, annál nagyobb a részecskék ütközési gyakorisága a tartály falai ellen; és ezért minél nagyobb a gáz által kifejtett nyomás.
Mit tartalmaz ez a törvény??
A Boyle által végzett kísérletek rámutatnak arra, hogy fordított kapcsolat van a gáz által elfoglalt térfogat és a rá gyakorolt nyomás között. A fent említett kapcsolat azonban nem teljesen lineáris, ahogy azt a Boyle-nek tulajdonított nyomás függvényében a térfogatváltozás grafikonja mutatja..
Boyle törvényében rámutatnak, hogy a gáz által elfoglalt térfogat fordítottan arányos a nyomással. Azt is jelezték, hogy a gáz nyomásának a térfogatának eredménye állandó.
Matematikai kifejezés
A Boyle-Mariotte törvény matematikai kifejezésének eléréséhez kezdjük:
V α 1 / P
Ha azt jelzi, hogy a gáz által elfoglalt térfogat fordítottan arányos a nyomással. Van azonban olyan konstans, amely meghatározza, hogy fordítottan arányos ez a kapcsolat.
V = k / P
Ahol k az arányosság állandója. A k törlése:
VP = k
A gáz térfogatának nyomása állandó. akkor:
V1P1 = k és V2P2 = k
És ebből levonható, hogy:
V1P1 = V2P2
Ez utóbbi a Boyle törvényének végső kifejezése vagy egyenlete.
Mi az? Milyen problémákat old meg Boyle törvénye??
Gőzgépek

A Boyle-Mariotte törvénye a gőzgépek működésére vonatkozik. Ez egy külső égésű motor, amely a hőmennyiség átalakulását vízmennyiségből mechanikus energiává teszi.
A vizet hermetikusan lezárt kazánban melegítik, és a keletkezett gőz nyomást gyakorol a Boyle-Mariote-törvény szerint, amely egy henger térfogatnövelését eredményezi egy dugattyú tolásával.
A dugattyú lineáris mozgása forgómozgássá alakul át a forgattyúk és forgattyúk rendszerének használatával, amely a mozdony kerekeit vagy egy villamos generátor forgórészét vezetheti..
Jelenleg az alternatív gőzmotor egy kis használt motor, mivel a villamos motor és a belső égésű motor a járművekben eltolódott..
Az italok kortyolgatása
Az üdítőital vagy gyümölcslé egy üvegből egy szívócsövön keresztül történő szopása a Boyle-Mariotte törvényhez kapcsolódik. Ha a levegőt a csőből szájjal szívják, csökken a nyomás a csőben.
Ez a nyomásesés megkönnyíti a folyadék felfelé irányuló mozgását a csőben, lehetővé téve annak lenyelését. Ugyanez az elv működik a vér extrakciójával fecskendő segítségével.
Légzőrendszer
A Boyle-Mariotte törvénye szorosan kapcsolódik a légzőrendszer működéséhez. Az inspirációs fázis során a membrán és más izmok összehúzódása következik be; például a külső bordázatok, amelyek a borda kinyúlását eredményezik.
Ez az intrapleuralis nyomás csökkenését okozza, ami tüdő expanziót okoz, ami a tüdő térfogatának növekedését eredményezi. Ezért az intrapulmonális nyomás csökken a Boyle-Mariotte törvényben leírtak szerint.
Amikor az intrapulmonális nyomás a légköri levegőbe kerül, a légköri levegő a tüdőbe áramlik, ami fokozott nyomást eredményez a tüdőben; a légköri nyomásra gyakorolt nyomás, és az inspiráció fázisának befejezése.
Ezt követően az inspiráló izmok ellazulnak és a kilégzési izmok megkötik. Emellett tüdő rugalmas rugalmas visszahúzódás következik be, amely a tüdő térfogatának csökkenését eredményezi, következésképpen az intrapulmonális nyomás növekedése, amit a Boyle-Mariotte törvény magyarázhat..
Az intrapulmonális nyomás növelésével és a légköri nyomásnál nagyobb levegővel a levegő a tüdő belsejéből a légkörbe áramlik. Ez addig következik be, amíg a nyomás kiegyenlítésre kerül, ami a lejárati fázist zárja le.
Példák (kísérletek)
1. kísérlet
Egy kis léggömböt szorosan lezárva helyezünk el, és a szájába csomót készítünk egy fecskendő belsejében, amelybe a dugattyút eltávolították, körülbelül 20 ml-t. A fecskendő dugattyúja a fecskendő középső része felé kerül, a tű eltávolításra kerül, és a levegő beömlőnyílása eltömődik.
megfigyelés
Az injektor dugattyújának lassú húzásával megfigyelhető, hogy a ballon felfújt.
magyarázat
A léggömb falára két nyomás következik be: a belső felületre gyakorolt nyomás, a léggömb belsejében levő levegő terméke és egy másik nyomás a ballon külső felületére, amelyet a fecskendőben lévő levegő befolyásol..
Az injektor dugattyújának húzásakor fél-vákuum keletkezik benne. Ezért a szivattyú falának külső felületén lévő levegőnyomás csökken, így a szivattyú belsejében lévő nyomás viszonylag nagyobb..
Ez a nettó nyomás a Boyle-Mariote-törvény szerint a ballon falának eltolódását és a ballon térfogatának növekedését eredményezi..
2. kísérlet
Vágjon le egy műanyag palackot, körülbelül félig, ügyelve arra, hogy a vágás a lehető legfeljebb vízszintes legyen. A palack szájában jól beállított léggömb kerül elhelyezésre, ugyanakkor egy bizonyos mennyiségű vizet mély edénybe helyezünk.
megfigyelés
Ha a palack alját a ballonnal helyezzük az edény vízébe, a léggömb mérsékelten felfújt.
magyarázat
A víz kiszorítja egy bizonyos mennyiségű levegőt, növelve a levegő nyomását a palack falán és a ballon belsejében. A Boyle-Mariotte törvénye szerint ez a földgömb térfogatának növekedését okozza, amelyet a földgömb inflációja mutat..
referenciák
- Wikipedia. (2019). Boyle törvénye. Lap forrása: en.wikipedia.org
- Az Encyclopaedia Britannica szerkesztői. (2018. július 27.). Boyle törvénye. Encyclopædia Britannica. A lap eredeti címe: britannica.com
- Helmenstine, Todd. (2018. december 5.). A Boyle törvénye. A lap eredeti címe: thinkco.com
- Fiatal indiai filmek. (2018. május 15.). Boyle törvénye: Tudományos kísérlet gyerekeknek. A lap eredeti címe: yifindia.com
- Cecilia Bembibre (2011. május 22.). Hőlégballon Meghatározás ABC. Visszaváltva: definicionabc.com
- Ganong, W, F. (2003). Orvosi fiziológia (19. kiadás). A Modern kézikönyv szerkesztősége.


