Broglie atomi modelljellemzői és korlátozásai
az Broglie atomi modell A francia fizikus, Louis Broglie 1924-ben javasolta. Doktori értekezésében Broglie az elektronok hullámrészecske kettősségét támasztotta alá, a hullámszerkezet alapjait. Broglie fontos elméleti megállapításokat tett közzé az anyag hullámhártya-jellegéről az atomi skálán.
Ezt követően a Broglie-állításokat 1927-ben kísérletesen demonstrálták Clinton Davisson és Lester Germer tudósok. A Broglie elektronhullám-elmélete Einstein javaslatára épül a fény hullámtulajdonságaira rövid hullámhosszon.
Broglie bejelentette, hogy az anyagnak hasonló a viselkedése, mint a fény, és hasonló tulajdonságokat javasolt a szubatomi részecskékben, például az elektronokban..
Az elektromos töltések és pályák korlátozzák az elektronok által leírt hullám amplitúdóját, hosszát és frekvenciáját. Broglie elmagyarázta az elektronok mozgását az atommag körül.
index
- 1 A Broglie atommodell jellemzői
- 2 Davisson és Germer kísérlet
- 3 Korlátozások
- 4 Érdekes cikkek
- 5 Referenciák
A Broglie atommodell jellemzői
A javaslatának fejlesztése érdekében Broglie azon az elven alapult, hogy az elektronok kettős természetűek a hullám és a részecske között, hasonlóan a fényhez.
Ebben az értelemben Broglie mindkét jelenséget összehasonlította, és az Einstein által a fény hullám természetének tanulmányozására kifejlesztett egyenletek alapján a következőket jelezte:
- A foton teljes energiája és következésképpen az elektron teljes energiája a hullám frekvenciájának és a Plank konstansnak a eredménye (6.62606957 (29) × 10). -34 Jules x másodperc), amint azt a következő kifejezés tartalmazza:
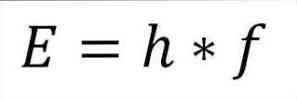
Ebben a kifejezésben:
E = elektronenergia.
h = Plank állandó.
f = a hullám frekvenciája.
- A foton, és így az elektron lineáris momentuma fordítottan arányos a hullámhosszúsággal, és mindkét nagysága a Plank konstanson keresztül kapcsolódik:
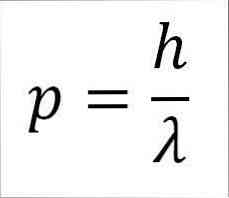
Ebben a kifejezésben:
p = az elektron lineáris pillanata.
h = Plank állandó.
λ = hullámhossz.
- A lineáris lendület a részecske tömegének eredménye, a részecske elmozdulás közbeni sebességével.
Ha az előző matematikai kifejezést hullámhossz függvényében átalakítják, akkor a következő:
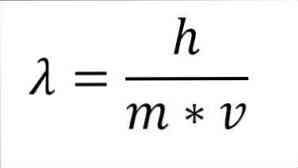
Az említett kifejezésben:
λ = hullámhossz.
h = Plank állandó.
m = az elektron tömege.
v = elektronsebesség.
Mivel h, a Plank konstansnak van egy kis értéke, a λ hullámhossz is. Ebből következően megállapítható, hogy az elektron hullámtulajdonságai csak atomi és szubatomi szinteken fordulnak elő.
- A Broglie a Bohr atomi modelljének posztulátumain is alapul. Az utóbbi szerint az elektronok pályái korlátozottak, és csak egész számok többszörösek lehetnek. így:
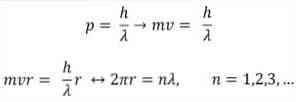
ahol:
λ = hullámhossz.
h = Plank állandó.
m = az elektron tömege.
v = elektronsebesség.
r = a pálya sugara.
n = egész szám.
A Bohr atommodell szerint, amelyet Broglie alapul vett, ha az elektronok úgy viselkednek, mint az állandó hullámok, az egyetlen megengedett pálya azok, amelyek sugara megegyezik a λ hullámhossz integrális többszörösével..
Ezért nem minden pálya felel meg az ahhoz szükséges paramétereknek, hogy egy elektron áthaladjon rajtuk. Ezért az elektronok csak bizonyos pályákon utazhatnak.
A Broglie elektronok hullámelmélete indokolta a Bohr atommodell sikerét a hidrogénatom egyetlen elektronjának viselkedésének magyarázatára.
Ugyanígy megvilágítottuk azt is, hogy ez a modell nem illeszkedik a bonyolultabb rendszerekhez, azaz az egynél több elektronhoz tartozó atomokhoz..
Davisson és Germer kísérlet
A Broglie atommodell kísérleti ellenőrzése 3 évvel a kiadás után történt, 1927-ben.
A kiemelkedő amerikai fizikusok, Clinton J. Davisson és Lester Germer kísérletileg megerősítették a hullámszerkezet elméletét.
Davisson és Germer egy elektronsugaras szórási vizsgálatot végeztek egy nikkel-kristályon keresztül, és megfigyelték a diffrakciós jelenséget a fémközegen keresztül.
Az elvégzett kísérlet a következő eljárás végrehajtását tartalmazza:
- Először az elektron sugárral ellátott szerelvényt helyeztük el, amely ismert kezdeti energiával rendelkezett.
- Feszültségforrást telepítettünk az elektronok mozgásának felgyorsítására, ami potenciális különbséget keltett.
- Az elektronsugár áramlása egy fémkristály felé irányult; ebben az esetben nikkel.
- A nikkel kristályokra ható elektronok számát mértük.
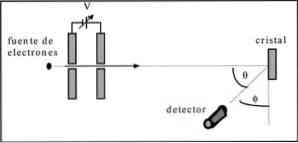
A kísérlet végén Davisson és Germer észlelték, hogy az elektronok különböző irányokban szétszóródtak.
A kísérletet különböző orientációkkal rendelkező fémkristályok használatával ismételve a tudósok a következőket észlelték:
- Az elektronsugárnak a fémkristályon keresztüli diszperziója hasonló volt a fénysugarak interferenciájához és diffrakciójához..
- Az elektronok tükröződése az ütközőkristályban azt a pályát írta le, amely elméletileg a Broglie elektron hullámainak elmélete szerint kell leírnia..
A szintézis során a Davisson és a Germer kísérlete kísérletileg igazolta az elektronok kettős hullámrészecske jellegét.
korlátozások
A Broglie atomi modell nem jósolja meg az elektron pontos helyét azon a pályán, amelyben mozog.
Ebben a modellben az elektronokat olyan hullámokként érzékelik, amelyek egy adott hely nélkül mozognak a pályán, ami bevezeti az elektronikus pálya fogalmát.
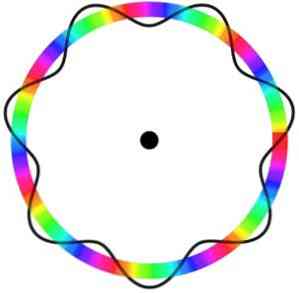
Emellett a Schrödinger modelljéhez hasonlóan a Broglie atommodell nem veszi figyelembe az elektronok forgását a tengelyén (pörgés).
Az elektronok belső szögsebességének figyelmen kívül hagyásával e szubatomi részecskék térbeli variációi elhanyagolhatók..
Ugyanebben az ötletrendben ez a modell nem veszi figyelembe a gyors elektronok viselkedésének változásait a relativisztikus hatások következtében.
Érdekes cikkek
Schrödinger atomi modellje.
Chadwick atommodellje.
Heisenberg atomi modellje.
Perrin atomi modellje.
Thomson atomi modellje.
Dalton atomi modellje.
Dirac Jordan atomi modellje.
A demokrata atommodellje.
Bohr atomi modellje.
referenciák
- Bohr kvantumelmélete és De Broglie hullámai (s.f.). Lap forrása: ne.phys.kyushu-u.ac.j
- Louis de Broglie - Életrajz (1929). © A Nobel Alapítvány. Lap forrása: nobelprize.org
- Louis-Victor de Broglie (s.f.). A lap eredeti címe: chemed.chem.purdue.edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. A lap eredeti címe: britannica.com
- De Broglie atomi modellje. Országos Távoktatási Egyetem. Spanyolországban. A lap eredeti címe: ocw.innova.uned.es
- Louis De Broglie anyagának hullámai (s.f.). A lap eredeti címe: hiru.eus
- Von Pamel, O. és Marchisio, S. (s.f.). Kvantummechanika Rosario Nemzeti Egyetem. A lap eredeti címe: fceia.unr.edu.ar


