Atom térfogat Hogyan változik az időszakos táblázat és a példák
az atomi térfogat egy relatív érték, amely az elem moláris tömege és annak sűrűsége közötti kapcsolatot jelzi. Tehát ez a térfogat az elem sűrűségétől függ, és a sűrűség függ a fázistól és attól, hogy az atomok milyen módon vannak elrendezve..
Tehát a Z elem atomtérfogata nem azonos egy másik fázisban, amely különbözik a szobahőmérsékleten (folyadék, szilárd vagy gáz) megjelenő fázisban, vagy ha bizonyos vegyületek része. Így a Z vegyületben a Z atom atomtérfogata különbözik a Z vegyület Z Z-jában lévő térfogatától.

Miért? Ennek megértéséhez szükséges az atomok összehasonlítása például a golyókkal. A golyók, mint a kiváló kép kékes féleségei, nagyon jól definiálták anyagi határukat, amit a ragyogó felületének köszönhetünk. Ezzel szemben az atomok határa diffúz, bár távolról gömb alakúnak tekinthető.
Így az atomhatáron túli pontot meghatározó tényező az elektron megtalálásának null valószínűsége, és ez a pont lehet távolabb vagy közelebb a maghoz, attól függően, hogy hány szomszédos atom kapcsolódik egymáshoz az atom körül..
index
- 1 Atom térfogata és sugara
- 2 Kiegészítő képlet
- 3 Hogyan változik az atomtérfogat a periodikus táblázatban?
- 3.1 Az átmeneti fémek atommennyisége
- 4 Példák
- 4.1 1. példa
- 4.2 2. példa
- 5 Referenciák
Atom térfogata és sugara
A H-molekula két H-atomjának kölcsönhatásával2, meghatározták magjaik pozícióit, valamint a köztük lévő távolságokat (nukleáris távolságok). Ha mindkét atom gömb alakú, a sugár a mag és a diffúz határ közötti távolság:
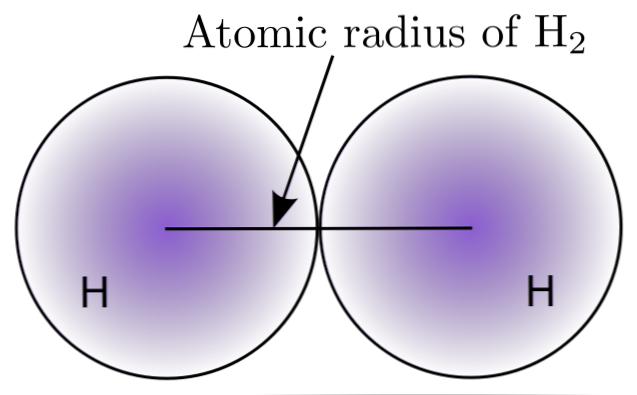
A felső képen látható, hogy az elektronok megtalálásának valószínűsége csökken, amikor elmozdul a magtól. A kettő közötti nukleáris távolságot elválasztva az atom sugarát kapjuk. Ezután az atomok gömb alakú geometriáját feltételezve a gömb térfogatának kiszámításához használjuk a képletet:
V = (4/3) (Pi) r3
Ebben az kifejezésben az R a H molekulához meghatározott atom sugár2. Ezzel a pontatlansággal kiszámított V érték akkor változhat, ha például H-t vettünk figyelembe2 folyékony vagy fémes állapotban. Ez a módszer azonban nagyon pontatlan, mivel az atomok alakja messze van az ideális szférától az interakciókban.
A szilárd anyagok atomi térfogatainak meghatározásához számos változót veszünk figyelembe az elrendezéssel kapcsolatban, és röntgendiffrakciós vizsgálatokkal nyerjük őket..
További képlet
A moláris tömeg kifejezi az anyag mennyiségét, amely egy mólnyi kémiai elem atomjával rendelkezik.
Egységei g / mol. Másrészt a sűrűség az a térfogat, amely egy grammot foglal magában: g / ml. Mivel az atomtérfogat egység / ml, akkor a kívánt egységek eléréséhez a változókkal kell játszani:
(g / mol) (ml / g) = ml / mol
Vagy mi ugyanaz:
(Móltömeg) (1 / D) = V
(Moláris tömeg / D) = V
Így az elem egy atomjának egy móljának térfogata könnyen kiszámítható; míg a gömb térfogatának képletében egy egyedi atom térfogata kiszámításra kerül. Ahhoz, hogy ezt az értéket elérjük az elsőből, az Avogadro számával (6.02 · 10) van szükség konverzióra.-23).
Hogyan változik az atomtérfogat a periodikus táblázatban?
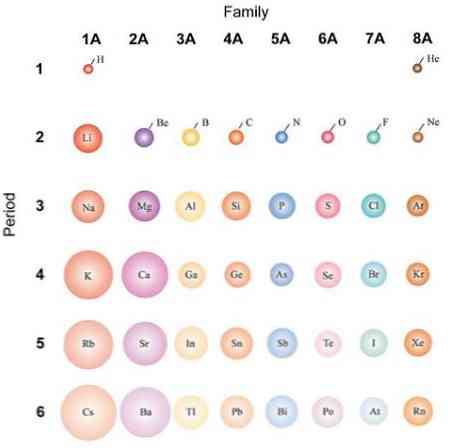
Ha az atomok gömb alakúak, akkor azok változása ugyanaz lesz, mint az atomi sugárban megfigyelt. A felső képen, amely bemutatja a reprezentatív elemeket, látható, hogy jobbról balra az atomok törpe; ahelyett, hogy felülről lefelé ezek nagyobbak lennének.
Ez azért van, mert ugyanabban az időszakban a mag magában foglalja a protonokat, ahogy a jobbra mozog. Ezek a protonok vonzó hatást gyakorolnak a külső elektronokra, amelyek hatékony nukleáris töltést éreznek Zeff, kevesebb, mint a tényleges nukleáris töltés Z.
A belső rétegek elektronjai visszavonják a külső rétegét, csökkentve a magok hatását ezekre; Ezt nevezzük képernyőhatásnak. Ugyanebben az időszakban a képernyő hatása nem képes ellensúlyozni a protonok számának növekedését, így a belső rétegben lévő elektronok nem akadályozzák meg az atomok összehúzódását..
Egy csoportba való leszálláskor azonban új energiaszintek vannak engedélyezve, amelyek lehetővé teszik az elektronok számára, hogy a magtól távolabbra keringjenek. Emellett a belső rétegben az elektronok száma növekszik, amelyek árnyékoló hatásai csökkennek, ha a mag protonokat ad hozzá.
Ezekből az okokból látható, hogy az 1A csoportnak a legnagyobb volumenű atomja van, ellentétben a 8A csoport (vagy a 18) kis atomjaival, a nemesgázokkal..
Az átmeneti fémek atommennyiségei
Az átmeneti fémek atomjai elektronokat tartalmaznak a belső orbitákhoz d. A képernyőn megjelenő effektus növekedése és a tényleges Z-töltés szinte egyformán törlődik, hogy atomjaik ugyanabban az időszakban megtartsák hasonló méretüket.
Más szavakkal: egy periódusban az átmeneti fémek hasonló atomtérfogatokat mutatnak. Ezek a kis különbségek azonban rendkívül jelentősek a fémkristályok meghatározásakor (mintha fém golyók lennének).
Példák
Két matematikai képlet áll rendelkezésre egy elem atomtérfogatának kiszámításához, amelyek mindegyike a megfelelő példákkal rendelkezik.
1. példa
Tekintettel a hidrogén atom sugarára -37 pm (1 pikométer = 10)-12m) - és a cézium--265 pm-es, az atomtérfogatát.
A gömb alakú kötet képletének felhasználásával:
VH= (4/3) (3.14) (37 óra)3= 212,07 pm3
VCs= (4/3) (3.14) (265 óra)3= 77912297,67 pm3
Azonban a pirométerekben kifejezett térfogatok túlzott mértékűek, így átszámolódnak az angström egységekké, megszorozva azokat a konverziós tényezővel (1 / 100pm).3:
(212.073) (1 / 100pm)3= 2,1207 × 10-4 Å3
(77912297,67 pm3) (1 / 100pm)3= 77,912 Å3
Tehát a H kis atomja és a csekély Cs atomja közötti méretbeli különbségek számszerűen nyilvánvalóak. Emlékeztetni kell arra, hogy ezek a számítások csak közelítenek ahhoz az állításhoz, hogy egy atom teljesen gömb alakú, amely a valóság szemében halad..
2. példa

A tiszta arany sűrűsége 19,32 g / ml, móltömege 196,97 g / mol. Az M / D képlet alkalmazásával egy mólnyi aranyatom mennyiségének kiszámításához a következő:
VAu= (196,97 g / mol) / (19,32 g / ml) = 10,19 ml / mol
Ez azt jelenti, hogy 1 mól aranyatomok 10,19 ml-t foglalnak el, de milyen mennyiséget foglal magában egy aranyatom? És hogyan fejezzük ki azt pm egységben3? Ehhez egyszerűen alkalmazza az alábbi konverziós tényezőket:
(10,19 ml / mol) · (mol / 6,02-10)-23 atomok · · (1 m / 100 cm)3· (13.00 / 10.)-12m)3= 16,92 · 106 pm3
Másrészt az arany atommagja 166 óra. Ha összehasonlítod mindkét kötetet - az előző módszerrel kapott és a gömbköteg képletével kiszámított kötetet -, akkor azt tapasztaljuk, hogy nem azonos értékűek:
VAu= (4/3) (3.14) (166 óra)3= 19,15 · 106 pm3
A kettő közül melyik a legközelebb van az elfogadott értékhez? Az arany kristályos szerkezete röntgendiffrakciójával kapott kísérleti eredményekhez legközelebb eső.
referenciák
- Helmenstine, Anne Marie, Ph.D. (2017. december 09.). Atom térfogat meghatározása. Született 2018. június 6-án, a következőtől: thinkco.com
- Mayfair, Andrew. (2018. március 13.). Hogyan számítsuk ki az Atom térfogatát? sciencing. A (z) 2018. június 6-án a következő címen szerezhető be: sciencing.com
- Wiki Kids Kft. (2018). Lothar Meyer atomi térfogat görbék. 2018. június 6-án, a következő címen szerezhető be: wonderwhizkids.com
- Lumen. Periódusos trendek: atomi sugár. 2018. június 6-án, a következő címen szereztük be: courses.lumenlearning.com
- Camilo J. Derpich. Hangerő és atomi sűrűség. Született 2018. június 6-án: es-puraquimica.weebly.com
- Whitten, Davis, Peck és Stanley. Kémia. (8. kiadás). CENGAGE Learning, 222-224. O.
- CK-12 Alapítvány. (2010. február 22.). Összehasonlító atomméretek. [Ábra]. A (z) 2018. június 6-án, a következő címen szerezhető be: commons.wikimedia.org
- CK-12 Alapítvány. (2010. február 22.). H atomi sugara2. [Ábra]. A (z) 2018. június 6-án, a következő címen szerezhető be: commons.wikimedia.org


