Ezüst-oxid (Ag2O) szerkezete, tulajdonságai, nómenklatúrája és felhasználása
az ezüst-oxid egy szervetlen vegyület, amelynek kémiai képlete Ag2O. Az atomot egyesítő erő teljesen ionos természetű; ezért egy ionos szilárd anyagból áll, ahol két Ag kation aránya van+ az anion O-val elektrosztatikusan kölcsönhatásba lép2-.
Az oxid anion, O2-, ez a felület ezüstatomjainak a környezet oxigénjével való kölcsönhatásából ered; hasonlóan a vashoz és sok más fémhez. Az ezüst-oxidra jellemző ezüstdarab vagy ékszer a rozsdásodás és a rozsdásodás helyett fekete színű.

Például a fenti képen egy rozsdás ezüst csésze látható. Figyeljük meg a feketével borított felületet, bár még mindig megmarad néhány díszes csillogás; ezért még a rozsdás ezüst tárgyak is elég vonzónak tekinthetők a dekoratív használatra.
Az ezüst-oxid tulajdonságai olyanok, hogy első látásra nem rontják az eredeti fémfelületet. Szobahőmérsékleten, a levegőben lévő oxigénnel való egyszerű érintkezéssel alakul ki; és még érdekesebb, magas hőmérsékleten (200 ° C felett) bomlik.
Ez azt jelenti, hogy ha a kép üvegét tartották, és intenzív láng hőjét alkalmazták, visszanyerte az ezüstös fényét. Ezért kialakulása termodinamikailag reverzibilis folyamat.
Az ezüst-oxidnak más tulajdonságai is vannak, és az egyszerű Ag-formula mellett2Vagy magában foglalja a bonyolult strukturális szervezeteket és a szilárd anyagok gazdag választékát. Azonban az Ag2Vagy talán az Ag mellett2O3, az ezüst oxidjainak leginkább reprezentatív.
index
- 1 Az ezüst-oxid szerkezete
- 1.1 A valencia számának változása
- 2 Fizikai és kémiai tulajdonságok
- 2.1 Molekulatömeg
- 2.2 Megjelenés
- 2.3 Sűrűség
- 2.4 Olvadáspont
- 2,5 Kps
- 2.6 Oldhatóság
- 2.7 Kovalens karakter
- 2.8 Bomlás
- 3 Nómenklatúra
- 3.1. I és III
- 3.2 A komplex ezüst-oxidok szisztematikus nómenklatúrája
- 4 Felhasználások
- 5 Referenciák
Az ezüst-oxid szerkezete
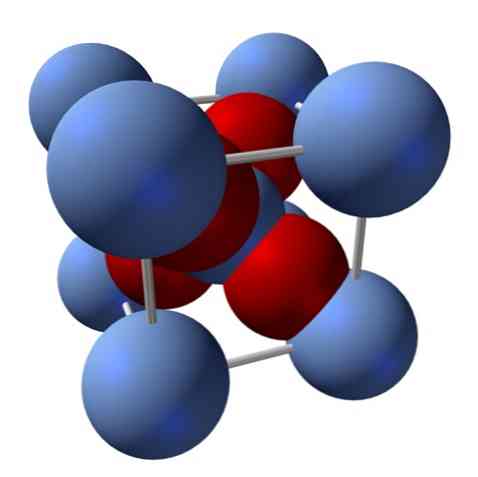
Hogyan van a szerkezete? Amint az elején említettük, ez egy ionos szilárd anyag. Ezért nem lehetnek kovalens kötések Ag-O és Ag = O szerkezetében; mivel, ha lenne, ennek az oxidnak a tulajdonságai drasztikusan változnak. Ekkor az Ag ionok+ és O2- 2: 1 arányban, és elektrosztatikus vonzódást tapasztal.
Az ezüst-oxid szerkezetét az az eredmény határozza meg, ahogyan az ion erők az Ag-ionok térben rendelkeznek+ és O2-.
A felső képen például egy egységcella van egy köbös kristályos rendszerhez: az Ag kationokhoz+ az ezüst kék gömbök és az O2- a vöröses gömbök.
Ha számítod a gömbök számát, úgy látod, hogy első pillantásra kilenc ezüstös kék és négy piros szín van. Azonban csak a kocka belsejében lévő gömbök töredékeit veszik figyelembe; ezeknek az összes gömbök részeként történő számlálásának meg kell felelnie az Ag 2: 1 arányának2O.
Ismételje meg az AgO tetraéder szerkezeti egységét4 négy másik Ag körül+, az összes fekete szilárd anyag épül (kiküszöböli a hiányosságokat vagy szabálytalanságokat, amelyeket ezek a kristályrendszerek rendelkezhetnek).
Változások a valencia számával
Most már nem az AgO tetraéderre fókuszál4 de az AgOAg sorban (figyelje meg a felső kocka csúcsait), hogy az ezüst-oxid szilárd anyag egy másik szempontból lineárisan elrendezett többszörös ionréteget tartalmaz (bár ferde). Mindez az Ag körüli "molekuláris" geometriából következik+.
A fentieket az ionszerkezet több tanulmánya is alátámasztotta.
Az ezüst főleg valens +1-vel működik, mivel az elektron elvesztése esetén a kapott elektronikus konfiguráció [Kr] 4d10, ami nagyon stabil. Más értékek, mint például az Ag2+ és Ag3+ kevésbé stabilak, mivel szinte teljesen kitöltötték az orbitális elektronokat.
Az Ag ion3+, azonban viszonylag kevésbé stabil az Ag-hoz képest2+. Valójában az Ag társaságában is létezhet+ Kémiailag gazdagítja a szerkezetet.
Elektronikus konfigurációja [Kr] 4d8, páratlan elektronokkal oly módon, hogy bizonyos stabilitást adjon neki.
Ellentétben az Ag ionok körüli lineáris geometriával+, megállapították, hogy az Ag ionoké3+ Négyzet alakú. Ezért egy ezüst-oxid Ag-ionokkal3+ az AgO négyzetekből álló rétegekből állna4 (nem tetraéder), elektrosztatikusan összekapcsolva AgOAg vonalakkal; Ilyen például az Ag4O4 vagy Ag2O ∙ Ag2O3 monoklin szerkezetű.
Fizikai és kémiai tulajdonságok

Ha karcolja meg a fő kép ezüst pohár felületét, akkor egy szilárd anyagot kapna, amely nem csak fekete, hanem barna vagy barna tónusokkal is rendelkezik (felső kép). A pillanatok által jelentett fizikai és kémiai tulajdonságainak egy része a következő:
Molekulatömeg
231,735 g / mol
megjelenés
Szilárd feketebarna por formában (vegye figyelembe, hogy annak ellenére, hogy ionos szilárd anyag, nem rendelkezik kristályos megjelenéssel). Szagtalan és vízzel keverve fém ízű
sűrűség
7,14 g / ml.
Olvadáspont
277-300 ° C. Természetesen ez tömör ezüstre olvad; azaz folyékony oxid képződése előtt valószínűleg lebomlik.
KPS
1,52 ∙ 10-8 vízben 20 ° C-on Ezért ez egy olyan vegyület, amely alig oldódik vízben.
oldhatóság
Ha gondosan megnézzük a szerkezetét, akkor azt találjuk, hogy Ag2+ és O2- Nem értenek egyet szinte méretben. Ennek eredményeként csak a kis molekulák tudnak behatolni a kristályrács belsejébe, így szinte minden oldószerben oldhatatlan; kivéve azokat, ahol reagál, például bázisokra és savakra.
Kovalens karakter
Bár ismételten azt mondták, hogy az ezüst-oxid ionos vegyület, bizonyos tulajdonságok, mint például az alacsony olvadáspont, ellentmondanak ennek az állításnak.
Természetesen a kovalens karakter figyelembevétele nem bontja le a szerkezetének magyarázatát, elég lenne hozzáadni az Ag szerkezetéhez.2Vagy a gömbök és a bárok modellje a kovalens kötések jelzésére.
Az AgO tetraéder és négyzetes síkja4, valamint az AgOAg vonalakhoz kovalens (vagy kovalens ionos) kötések kapcsolódnak.
Ezt szem előtt tartva az Ag2Vagy valójában polimer lenne. Javasoljuk azonban, hogy azt kovalens karakterrel rendelkező ionos szilárd anyagként tekintsék (amelynek a jellege ma még mindig kihívás).
bomlás
Elsőként megemlítették, hogy termodinamikailag reverzibilis, ezért a fémes állapotba való visszatérés érdekében elnyeli a hőt. Mindez két reakcióegyenletben kifejezhető:
4Ag (s) + O2(g) => 2Ag2O (s) + Q
2AG2O (s) + Q => 4Ag (s) + O2(G)
Ahol Q jelentése az egyenletben lévő hő. Ez megmagyarázza, hogy a rozsdás ezüstpohár felszínét égő tűz visszaviszi az ezüstös fényét.
Ezért nehéz feltételezni, hogy van Ag2O (l), mivel hővel azonnal lebomlik; kivéve, ha a nyomás túl nagy ahhoz, hogy megkapja a barna színű folyadékot.
nómenklatúra
Amikor bevezetésre került az Ag ionok lehetősége2+ és Ag3+ a közös és a domináns Ag mellett+, az „ezüst-oxid” kifejezés úgy tűnik, hogy elégtelen ahhoz, hogy az Ag-ra utaljon2O.
Ez azért van, mert az Ag ion+ bőségesebb, mint a többiek, így az Ag-t fogják venni2Vagy mint az egyetlen oxid; ami egyáltalán nem helyes.
Ha úgy gondolja, hogy az Ag2+ mivel az instabilitás miatt gyakorlatilag nem létezik, akkor csak a +1 és +3 értékekkel rendelkező ionok lesznek jelen; azaz Ag (I) és Ag (III).
Valencias I és III
Mivel az Ag (I) a legkevésbé valens, akkor az elnevezést az -oso melléknév hozzáadásával nevezzük el Argentum. Szóval, az Ag2Vagy ez az: argentoszoxid, vagy a szisztematikus nómenklatúra szerint diploma monoxid.
Ha az Ag (III) teljesen figyelmen kívül hagyja, akkor a hagyományos nómenklatúrája az argentin-oxid helyett: ezüst-oxid..
Másrészről az Ag (III), amely a nagyobb valencia, hozzáadódik a -ico utótag nevéhez. Szóval, az Ag2O3 az: ezüst-oxid (2 Ag ion)3+ három O-val2-). Szintén a szisztematikus nómenklatúra szerinti neve: diplata trioxide.
Ha az Ag szerkezetét megfigyelik2O3, feltételezhető, hogy az ózon oxidálódik, OR3, oxigén helyett. Ezért kovalens karakterének nagyobbnak kell lennie, mivel egy kovalens vegyület Ag-O-O-O-Ag vagy Ag-O kötéssel.3-Ag.
A komplex ezüst-oxidok szisztematikus nómenklatúrája
Az AgO, amelyet Ag-nek is írtak4O4 vagy Ag2O ∙ Ag2O3, ez egy ezüst-oxid (I, III), mivel mindkét szelepe +1 és +3. A szisztematikus nómenklatúra szerinti neve: tetraplate tetraoxid.
Ez a nómenklatúra nagy segítséget nyújt más sztöchiometrikusan összetettebb ezüst-oxidok esetében. Tegyük fel például, hogy a két szilárd anyag 2Ag2O ∙ Ag2O3 és Ag2O ∙ 3Ag2O3.
Az első megfogalmazása megfelelőbb módon lenne: Ag6O5 (Ag és O atomok számozása és hozzáadása). A neve tehát hexaplate pentoxid lenne. Megjegyezzük, hogy ez az oxid kevésbé gazdag ezüst összetételű, mint az Ag2O (6: 5.) < 2:1).
A második szilárd anyag írásakor egyébként: Ag8O10. A neve oktaplate dekaoxid lenne (8: 10 vagy 4: 5 arányban). Ez a hipotetikus ezüst-oxid "nagyon oxidált" lenne..
alkalmazások
Az ezüst-oxid új és kifinomult felhasználását kereső tanulmányok ma is folynak. Néhány felhasználása az alábbiakban található:
-Az oldatot ammóniában, ammónium-nitrátban és vízben oldjuk, hogy a Tollens reagens képződjön. Ez a reagens hasznos eszköz a szerves kémiai laboratóriumokban végzett minőségi vizsgálatokban. Lehetővé teszi az aldehidek jelenlétének meghatározását a mintában, a pozitív válasz az "ezüst tükör" képződése a kémcsőben..
-A fém cinkkel együtt az ezüst cink-oxid elsődleges elemeit képezi. Ez talán az egyik leggyakoribb és legelterjedtebb felhasználása.
-Gáztisztítóként szolgál, például a CO2. Melegítéskor felszabadítja a csapdába esett gázokat, és többször újra felhasználható.
-Az ezüst antimikrobiális tulajdonságai miatt oxidja hasznos a bioanalízis és a talajtisztítás vizsgálatában.
-Enyhe oxidálószer, amely képes aldehideket karbonsavakká oxidálni. Azt is használják a Hofmann-reakcióban (tercier aminok) és részt vesz más szerves reakciókban, akár reagensként, akár katalizátorként..
referenciák
- Bergstresser M. (2018). Ezüst-oxid: képlet, bomlás és képződés. Tanulmány. Visszaváltva: study.com
- A III / 17E-17F-41C kötet szerzői és szerkesztői. (N.d.). Ezüst-oxidok (Ag (x) O (y)) kristályszerkezet, rácsparaméterek. (Numerikus adatok és funkcionális kapcsolatok a tudomány és a technológia területén), 41C. Springer, Berlin, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). A Biofield energiakezelés lehetséges hatása az ezüst-oxid por fizikai és termikus tulajdonságaira. International Journal of Biomedical Science and Engineering. Vol. 3, No. 5, pp. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Ezüst-oxid bomlása. Oregoni Egyetem A lap eredeti címe: chemdemos.uoregon.edu
- Flint, Deyanda. (2014. április 24.). Ezüst-oxid akkumulátorok használata. Sciencing. A lap eredeti címe: sciencing.com
- Salman Montasir E. (2016). Az ezüst-oxid (Ag2o) néhány optikai tulajdonságának vizsgálata UVVizible spektrofotométerrel. [PDF]. A lap eredeti címe: iosrjournals.org
- Bard Allen J. (1985). Standard vizes oldatok. Marcel Dekker. A lap eredeti címe: books.google.co.ve


