Helicobacter pylori jellemzői, morfológiája, élőhelye, patológiája
Helicobacter pylori egy Gram-negatív helikális baktérium, amely részt vesz a gastritis, a peptikus fekélyek kialakulásában és a gyomorrákban. 1983-ban felfedezték Robin Warren és Barry Marshall az ausztrál patológusok, amikor megvizsgálják az emberi gyomor nyálkahártyáit..
Még Marshall is kísérletezett magával, lenyelve a baktériumokkal szennyezett anyagot, ahol úgy találta, hogy gasztitist termelt, és képes volt ellenőrizni a baktériumok jelenlétét a saját gyomor biopsziájában. Azt is megállapította, hogy válaszolt az antibiotikum kezelésre.
Ez megszüntette a régi elméleteket, amelyek azt állították, hogy a gyomorhurut fűszeres ételek vagy stressz okozta. Ezért 2005-ben Warren és marsall elnyerte a Nobel-díjat az orvostudományban.
index
- 1 Általános jellemzők
- 2 Élőhely
- 3 Virulencia faktorok
- 3.1 Flagella
- 3.2 Ragasztók
- 3.3 Lipopoliszacharidok (LPS)
- 3.4 Karbamid
- 3.5 vakuolizáló citotoxin (VacA)
- 3.6 Cytotoxin (CagA)
- 3.7 Szuperoxid-diszmutáz és kataláz
- 3.8 Nitrogén-oxid indukálható szintézis (iNOS):
- 3.9 Foszfolipázok, lipázok és mucinázok
- 4 Taxonómia
- 5 Morfológia
- 6 Diagnózis
- 6.1 - Invazív módszerek
- 6.2 Nem invazív módszerek
- 7 Életciklus
- 8 Patogenezis
- 8.1 Gyulladásos beszivárgás
- 9 Patológia
- 10 Klinikai manifesztáció
- 11 Kontagion
- 12 Kezelés
- 13 Referenciák
Általános jellemzők
A Campylobacter nemzetséghez viszonyított nagyszerűsége miatt eredetileg ezt hívták Campylobacter pyloridis és később Campylobacter pylori, de aztán új műfajba sorolták át.
A fertőzés által Helicobacter pylori Sok elterjedt országban széles körben elterjedt, és az egyik leggyakoribb fertőzés az emberben, ami általában gyermekkora óta következik be..
Úgy gondoljuk, hogy ha először szerezték be a mikroorganizmust, ez évekig, vagy egy életen át maradhat, bizonyos esetekben tünetmentes..
Másrészről, a gyomor nem tűnik az egyetlen olyan helynek, ahol a mikroorganizmust el lehet helyezni. H. pylori a gyomor kolonizálása előtt konszolidálható a szájban.
Hasonlóképpen lehetséges, hogy H. pylori A szájüregben jelenlévő betegek a kezelés után újra fertőzhetik a gyomrot. Ezt erősíti meg az a megállapítás, hogy egyes tünetmentes gyerekeket izoláltak a fogpapírból.
Azonban, bár a fertőzés Helicobacter pylori Egyes embereknél az aszimptomatikus folyamat nem ártalmatlan, a duodenális fekélyek 95% -ával, a peptikus fekélyek 70% -ával és a krónikus gyomorhurut 100% -ával kapcsolatos..
is, Helicobacter pylori a Nemzetközi Rákkutatási Ügynökség által a fertőzés és a gyomorrák között fennálló kapcsolat miatt az I. osztályú rákkeltő anyagnak minősül..
élőhely
Helicobacter pylori a következő vendégeket találták: ember, majom és macskák.
Ez a baktérium mikroaerofil légkört igényel (10% CO)2, 5% O2 és 85% -a N2) termeszteni, a vas a növekedés és az anyagcsere lényeges eleme.
A növekedés optimális hőmérséklete 35 ° C és 37 ° C között van, bár néhány törzs 42 ° C-on képes fejlődni. Hasonlóképpen, bizonyos fokú páratartalom kedvez a növekedésnek.
Helicobacter pylori A laboratóriumban lassan növekszik, 3–5 napig, sőt akár 7 napig is igényelheti a kolónia közepét..
A tenyésztéshez nem szelektív, vérrel kiegészített táptalaj használható.
Másrészt, Helicobacter pylori Jellemzője, hogy mozgó, és spirális alakja lehetővé teszi, hogy helixben mozogjon, mintha csavart lenne. Ez segít a gyomor nyálkán való mozgásban.
Ugyancsak kataláz és oxidáz pozitív és nagy ureazt termelő, az utóbbi alapvető szerepet játszik a mikroorganizmusban. Az ureazis lehetővé teszi, hogy a savas pH-értékű környezetben túlélje az ammóniát generálva, ami segít a pH lúgosításában.
A mikroorganizmusnak 6–7 pH-értékre van szüksége a proliferációhoz. Ehhez az ureáz használata mellett a gyomor nyálkahártyája alá kerül, ahol a gyomor nyálka megvédi a gyomor lumen szélsőséges savasságától (pH 1,0 - 2,0).
Másrészt a baktériumok által kiváltott proteázok módosítják a gyomor nyálkáját, csökkentve annak a lehetőségét, hogy a sav diffúz a nyálkahártyán keresztül..
Virulencia faktorok
megpróbáltatásokat
A baktériumok mozgása virulencia tényezőt jelent, mivel segít a gyomor nyálkahártyájának gyarmatosításában.
adhesint
A baktérium pilimális és fimbrialis hemagglutinint mutat, amely a mikroorganizmusnak a gyomor- és nyombélsejtekhez való tapadására hat..
A ragaszkodás a baktériumok stratégiája, hogy ellenálljon a nyálkahártya réteg perisztaltikájának, ahol tartózkodnak, hogy később az epiteliális sejtekbe vándoroljanak.
Másrészről a sziálsav specifikus hemagglutininjei a nyálkahártya felületén késleltetik a tapadás és a lenyelésüket. H. pylori.
Lipopoliszacharidok (LPS)
Ez endotoxikus, mint a többi Gram-negatív baktérium LPS. A tisztított antigén apoptózist indukálhat.
ureáz
A baktériumok ureazt termelnek a karbamid ammóniában és szén-dioxidban történő lebontására.
Ez a művelet lehetővé teszi, hogy megtartsa lúgos pH-értékét, és így elkerülje a gyomorban lévő sósav elpusztítását, garantálva annak túlélését.
Ezt a tulajdonságot az Ura A gén kódolja.
Vacuolizáló citotoxin (VacA)
Olyan fehérje, amely a gyomor epithelialis sejtjeiben vakuolokat okoz, ezért a szöveti fekélyek. Ezt a VacA gén kódolja.
Cytotoxin (CagA)
A CagA génnel rendelkező törzsek virulensebbek. Ezek súlyos gastritis, atrophic gastritis, duodenitis és / vagy gyomorrák.
Ez a CagA citotoxin növeli a gyomorsejtek proliferációját apoptózis nélkül, ami a gyomor epithelium normál megújulási mintájának módosításához vezet..
Szuperoxid-diszmutáz és kataláz
Elengedhetetlen a neutrofilek O2-függő halálával szembeni védelemhez.
A baktériumokra mérgező metabolit, a hidrogén-peroxid lebontásával működik.
Indukálható nitrogén-oxid szintáz (iNOS):
A baktérium iNOS-t és makrofágokat indukál in vitro.
Ez a megállapítás azt sugallja, hogy a szintetáz indukciójával a magas nitrogén-monoxid-termelés az immunaktiválással együtt részt vesz a szövetkárosodásban..
Foszfolipázok, lipázok és mucinázok
Ezek lehetővé teszik a mikroorganizmusok behatolását a gyomornyálkahártya alá, majd módosítják a nyálkát úgy, hogy vízálló rétegként működjön, amely megvédi a gyomor-lumen savától..
Ezen a helyen is az immunválasz teljesen hatástalan.
taxonómia
tartomány: baktérium
törzs: Proteobacteria
osztály: epsilonproteobacteria
sorrendben: campylobacterales
család: Helicobacteraceae
műfaj: Helicobacter
fajok: pylori
morfológia
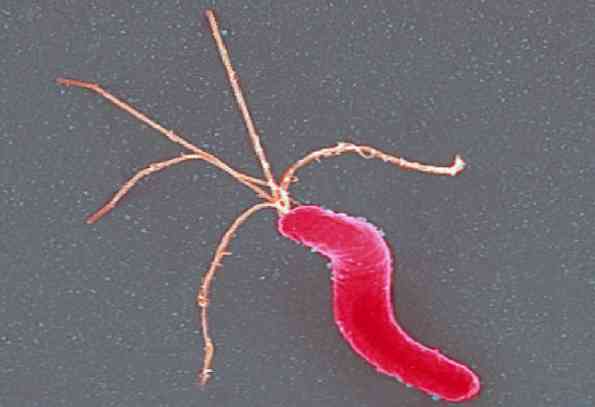
Helicobacter pylori Ez egy vékony Gram-negatív spirális bacillus, kicsi, ívelt és kissé makacs. Körülbelül 3 μm hosszú és 0,5 μm széles. Színezzük jól a Hematoxylin-Eosin, a módosított Giensa folt vagy a Warthin-Starry technikával.
Ez mobil, köszönhetően a több poláris flagellának (tuftban), összesen 4-6 között, amelyek jellemzően burkoltak..
A flagellát borító köpeny fehérjéket és lipopoliszacharidot tartalmaz, amelyek egyenértékűek a külső membrán összetevőivel. A funkció azonban nem ismert.
Nem képez spórákat, és nem zárt. A sejtfal hasonló a többi Gram-negatív baktériumhoz.
A kolóniák Helicobacter pylori Általában kis szürke és áttetsző. Amikor a telepek öregednek (hosszantartó tenyészetek), a bacilláris formák coccoidsá válnak.
diagnózis
A diagnózis Helicobacter pylori sok módszer van, és invazív és nem invazív besorolásúak.
-Invazív módszerek
Gyomor nyálkahártya-biopszia
Az endoszkópián keresztül, a legérzékenyebb módja a diagnózisnak Helicobacter pylori.
Mikroorganizmusok figyelhetők meg a szövetszakaszokban, és a nyálkahártya jelenlétének patognomonikus jellemzőit mutatja.
A hátránya az, hogy a forgalmazás H. pylori a gyomor nem egyenletes.
Gyors ureazteszt
A baktérium közvetett kimutatására szolgáló módszer.
A minták egy részét pH-indikátorral (fenolvörös) lévő karbamidlevesbe meríthetjük, és kevesebb mint egy órán belül megfigyelhetők az eredmények..
A karbamid-táptalaj a karbamidból származó ammónia termeléséből adódó pH-változás következtében sárgából fuksziává változik, ureazt okozva..
Ennek a vizsgálatnak az érzékenysége a gyomorban lévő bakteriális terheléstől függ.
Gyomor nyálkahártya minták termesztése
Az endoszkópia által vett minta egy részét meg lehet szántani. A negatív kultúra a terápia utáni gyógyítás legérzékenyebb mutatója.
A gyomor- vagy nyombélhártya-biopsziás mintának frissnek kell lennie, és szállítását nem szabad több mint 3 órával késleltetni. Legfeljebb 5 órán át tárolhatók 4 ° C-on, és a szövetet nedvesen kell tartani (2 ml steril fiziológiás sóoldattal ellátott tartályban)..
A minta vetését megelőzően makerát kell készíteni a nagyobb érzékenység elérése érdekében. A mintát Brucella agarra, agyi szív infúzióra, vagy szójabab triptikázra lehet felhordani 5% juh- vagy lóvérrel kiegészítve..
Polimeráz láncreakció (PCR).
A szövetszakaszokat molekuláris biológiai eljárásoknak vethetjük alá a mikroorganizmus DNS kimutatására.
A PCR előnye, hogy használható minták, például nyál analízisében, lehetővé téve a diagnózist H. pylori nem invazív, bár a baktériumok nyálban való jelenléte nem feltétlenül a gyomorfertőzés jele.
-Nem invazív módszerek
szerológiai
Ez a módszer 63–97% -os érzékenységgel rendelkezik. Az IgA, IgM és IGG antitestek mérése az ELISA technikával történik. Ez egy jó diagnosztikai lehetőség, de korlátozottan használható a kezelés ellenőrzésére.
Ez azért van így, mert az antitestek a mikroorganizmus megszűnése után 6 hónapig emelkedhetnek. Előnye, hogy gyors, egyszerű és olcsóbb módszer, mint a biopsziás endoszkópiát igénylő módszer.
Meg kell jegyezni, hogy az ellen termelt ellenanyagok H. pylori, Ezek diagnosztizálásra szolgálnak, de nem akadályozzák meg a gyarmatosítást. Ezért azok, akik megszerzik H. pylori krónikus betegségekben szenvednek.
Légzésvizsgálat
Ehhez a vizsgálathoz a páciensnek szénnel jelölt karbamidot kell bevennie (13C o 14C). Ezt a vegyületet a baktériumok által termelt urázzal érintkezve jelölt szén-dioxiddá (CO.) Alakítjuk át2 C14) és ammónium (NH2).
A szén-dioxid áthalad a véráramba és onnan a tüdőbe, ahol a levegőből kilélegzik. A páciens légzési mintáját egy léggömbben gyűjtöttük össze. A pozitív teszt megerősíti a baktérium fertőzését.
Módosított légzési teszt
Ez megegyezik az előzővel, de ebben az esetben egy 99mTc kolloidot adnak hozzá, amely nem szívódik fel az emésztőrendszerben..
Ez a kolloid lehetővé teszi a karbamid termelésének pontos megjelenítését az emésztőrendszer helyén, ahol gamma kamera képezi..
Életciklus
Helicobacter pylori A szervezeten belül két módon viselkedik:
A lakosság 98% - a. \ T H. pylori szabadon tartózkodnak a gyomor nyálkájában. Ez tartályként szolgál a tapadó baktériumokhoz, és az átviteli célra szolgál.
Míg 2% -aa epiteliális sejtekhez kapcsolódik, amelyek megtartják a fertőzést.
Ezért két populáció létezik, amelyek tapadnak és nem tapadnak a különböző túlélési jellemzőkkel.
kórtani
Amint a baktériumok bejutnak a szervezetbe, főleg a gyomor-antrumot kolonizálhatja, az általa alkalmazott virulencia faktorok felhasználásával..
A baktérium sokáig tarthat a gyomor nyálkahártyájába, néha életre anélkül, hogy kényelmetlenséget okozna. Megfertőzi és gyarmatosítja a gyomor- és nyombélfedő nyálka mély rétegeit proteázokon és foszfolipázokon keresztül.
Ezután a gyomor és a nyombél nyálkahártya felületes epitheliális sejtjeihez kötődik anélkül, hogy behatolna a falba. Ez a stratégiai hely, ahol a baktériumok megvédik magukat a gyomor fény rendkívül savas pH-jától.
Ezen a helyen egyidejűleg a baktériumok kibontják a karbamidot, hogy további lúgosítsák a környezetet és életképesek maradjanak.
Az idő nagy részében folyamatos gyulladásos reakció lép fel a gyomor nyálkahártyájában, ami viszont megváltoztatja a gyomorsav-szekréció szabályozási mechanizmusait. Így aktiválódnak bizonyos ulcerogén mechanizmusok, például:
A parietális sejtek funkciójának gátlása a szomatosztatin gátlásán keresztül, ahol a nem megfelelő gasztrin termelés előnyös..
A keletkezett ammónia és a VacA citotoxin rosszul kezeli az epiteliális sejteket, ezáltal a gyomor- vagy nyombélhártya-nyálkahártya-elváltozásokat okozva..
Ezért az epiteliális felület degeneratív változásait figyelték meg, beleértve a mucin-kimerülést, a citoplazmatikus vakuolizációt és a nyálmirigyek szétesését..
Gyulladásos beszivárgás
A fent említett sérülések következtében a nyálkahártya és a lamina propria behatol a gyulladásos sejtek sűrű infiltrátumába. Kezdetben csak a mononukleáris sejtekkel lehet az infiltrátum minimális.
De akkor a gyulladás neutrofilek és limfociták jelenlétével terjedhet, amelyek károsítják a nyálkahártyát és a parietális sejteket, sőt akár mikrobiózisok képződhetnek is..
A CagA citotoxin belép a gyomor-epiteliális sejtbe, ahol több, az aktin citoszkeleton átszervezését okozó enzimatikus reakció lép fel..
A karcinogenezis specifikus mechanizmusai nem ismertek. Ugyanakkor úgy vélik, hogy a gyulladás és az agresszió hosszú időn keresztül metaplazmát és hosszú távú rákot eredményez..
patológia
Általánosságban elmondható, hogy a krónikus felületes gyomorhurut néhány hét vagy hónap múlva keletkezik, miután a baktériumokat telepítették. Ez a gyomorhurut a gyomorfekély felé haladhat, majd lymphomát vagy gyomor-adenokarcinómát okozhat.
Szintén fertőzés Helicobacter pylori olyan állapot, amely a MALT-limfóma (a nyálkahártyához kapcsolódó limfoidszövet limfóma) szenvedését feltételezi..
Másrészt a legújabb tanulmányok ezt említik Helicobacter pylori extragasztikus betegségeket okoz. Ezek közül említhető a vashiányos anaemia és az idiopátiás thrombocytopenia purpura.
Szintén a bőrbetegségek, például a rosacea (leggyakoribb bőrbetegség) H. pylori), krónikus prurigo, krónikus idiopátiás csalánkiütés, psoriasis. Terhes nőknél hyperemesis gravidarum keletkezhet.
Más kevésbé gyakori helyek, ahol ezt hitték H. pylori a betegség bekövetkezése okozhat bizonyos kórképeket:
Középfül, orrpolipok, máj (hepatocelluláris karcinóma), epehólyag, tüdő (hörgőtágulás és krónikus obstruktív tüdőbetegség COPD).
Ez többek között a szembetegséghez (nyílt szögű glaukóma), a szív- és érrendszeri betegségekhez, az autoimmun betegségekhez is kapcsolódik..
Klinikai megnyilvánulások
Ez a patológia tünetmentes lehet a felnőttek 50% -ában. Ellenkező esetben az elsődleges fertőzésben hányingert és felső hasi fájdalmat okozhat, amely legfeljebb két hétig tarthat.
Később a tünetek eltűnnek, később jelentkeznek a gastritis és / vagy a peptikus fekély kialakulása után.
Ebben az esetben a leggyakoribb tünetek a hányinger, az anorexia, a hányás, az epigasztikus fájdalom és még kevésbé specifikus tünetek, mint pl..
A peptikus fekélyek súlyos vérzést okozhatnak, melyet a peritonitis komplikálhat a gyomor tartalmának a peritoneális üregbe történő szivárgása miatt..
fertőzés
Emberek Helicobacter pylori Kiválhatják a baktériumokat a székletben. Ily módon az ivóvíz szennyezett lehet. Ezért az egyén legfontosabb szennyezési útja a széklet-orális.
Úgy tartják, hogy lehet vízben vagy néhány zöldségben, amelyet általában nyersen fogyasztanak, például salátát és káposztát..
Ezek az élelmiszerek szennyezett vízzel történő öntözéssel szennyeződhetnek. A mikroorganizmust azonban soha nem izolálták vízből.
A szennyeződés egy másik módja a szóbeli-szóbeli, de Afrikában azt dokumentálta, hogy egyes anyák szokása szerint gyermekeik ételeit előzetesen felzavarják.
Végül az iatrogén útvonalon keresztül történő fertőzés lehetséges. Ez az út szennyezett vagy szennyezett vagy gyengén sterilizált anyag használatával jár, ha invazív eljárásokba kerül, amelyek a gyomornyálkahártyával érintkeznek..
kezelés
Helicobacter pylori in vitro Ez számos antibiotikumra érzékeny. Ezek közül: penicillin, néhány cefalosporin, makrolid, tetraciklin, nitroimidazol, nitrofurán, kinolon és bizmut-só.
De ezek a receptorok blokkolói (cimetidin és ranitidin), polimixin és trimetoprim ellenállnak..
A legsikeresebb kezelések között van:
- Gyógyszerek, köztük 2 antibiotikum és 1 protonpumpa inhibitor kombinációja.
- Az antibiotikumok leggyakrabban használt kombinációja a klaritromicin + metronidazol vagy klaritromicin + amoxicillin vagy klaritromicin + furazolidon vagy metronidazol + tetraciklin..
- A protonpumpa inhibitor lehet az omeprazol vagy az esomeprazol.
- Egyes terápiák magukban foglalhatják a bizmut-sók fogyasztását is.
A terápiát az FDA ajánlása szerint legalább 14 napig kell befejezni. Egyes betegeknél azonban ezt a terápiát nehéz tolerálni. Számukra ajánlott kombinálni a kezelést a probiotikumokat tartalmazó élelmiszerek fogyasztásával.
Ezek a terápiák hatékonyak, azonban az utóbbi években ellenállás volt Helicobacter pylori metronidazolra és klaritromicinre.
A mikroorganizmust fel lehet szüntetni, de lehetséges a fertőzés. Második terápiában az újrakezelés következtében a levofloxacin alkalmazása javasolt.
referenciák
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiológiai diagnózis. (5. kiadás). Argentína, szerkesztő Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. Bailey & Scott mikrobiológiai diagnózis. 12 ed. Argentínában. Szerkesztői Panamericana S.A; 2009.
- Ryan KJ, Ray C. Sherris. mikrobiológia Orvosi, 6. kiadás McGraw-Hill, New York, USA; 2010.
- Cava F és Cobas G. Két évtizede Helicobacter pylori. VacciMonitor, 2003; 2 (1): 1-10
- González M, González N. Orvosi mikrobiológiai kézikönyv. 2. kiadás, Venezuela: a Carabobo Egyetem média- és kiadványigazgatósága; 2011
- Testerman TL, Morris J. A gyomoron túl: a Helicobacter pylori patogenezisének, diagnózisának és kezelésének frissített nézete. Világ J Gastroenterol. 2014 20 (36): 12781-808.
- Safavi M, Sabourian R, Foroumadi A. A Helicobacter pylori fertőzés kezelése: Jelenlegi és jövőbeli betekintések. World J Clin ügyek. 2016; 4 (1): 5-19.


