Történelmi jellemzők, szerkezet, típusok és funkciók
az hiszton olyan bázisfehérjék, amelyek kölcsönhatásba lépnek a DNS-sel a nukleozomok képződésében, amelyek alkotják a kromatin szálakat, amelyek az eukarióta szervezetek kromoszómáit alkotják.
Nukleoszómákat, DNS-ek és fehérjék által képzett komplexeket 1974-ben fedeztek fel, és a hisztonok összegyűjtik ezt a kromatin szervezet alapszintjét. A hisztonfehérjék létezése azonban az 1960-as évek eleje óta ismert.
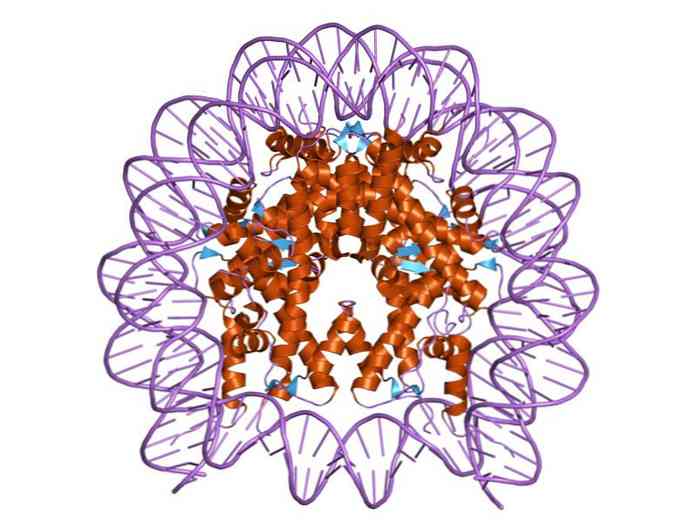
A hisztonok oly módon vannak elrendezve, hogy a DNS kettős sáv egy fehérje-centrumba kerüljön, amely ezekből a fehérjékből áll, amelyek szorosan együttműködnek egymással. A hiszton-központ lemez alakú és a DNS körülbelül 1,7 fordulatot tesz körülötte.
A többszörös hidrogénkötések lehetővé teszik a DNS kötődését a hisztonok által alkotott fehérje centrumhoz minden egyes nukleozomban. Ezeket a kötéseket többnyire a hisztonok aminosav-csontvázai és a DNS cukor-foszfát gerince között alakítják ki. Néhány hidrofób kölcsönhatás és ionos kötés is részt vesz.
A "kromatin remodeling komplexek" néven ismert fehérjék felelősek a DNS és a hisztonok közötti kötési kötések lebomlásáért és kialakulá-sáért, lehetővé téve a transzkripciós gép bejutását a nukleozomokban lévő DNS-be.
Annak ellenére, hogy a nukleinsavak a hisztonok által alkotott fehérje-centrumhoz közel vannak, ezek úgy vannak elrendezve, hogy szükség esetén lehetővé teszik a transzkripciós faktorok és más, az expresszióhoz vagy a genetikai csendesítéshez kapcsolódó fehérjék bejuttatását..
A hisztonok különböző módosításokat hajthatnak végre, amelyek többféle variánst hoznak létre, lehetővé téve a kromatin számos különböző formájának létezését, amelyek a génexpressziót különböző módon befolyásolják.
index
- 1 Jellemzők
- 2 Szerkezet
- 2.1. Union hisztonok
- 3 típus
- 3.1 Nukleoszomális hisztonok
- 3.2. Union hisztonok
- 4 Funkciók
- 5 Referenciák
jellemzői
Ezek a természetben leginkább konzervált eukarióta fehérjék. Kimutatták például, hogy a H4 borsó hiszton csak a H4 102 aminosav-pozíciójától csak kétben különbözik..
A hisztonok viszonylag kis fehérjék, legfeljebb 140 aminosavval. Ezek bázikus aminosavmaradékokban gazdagok, így pozitív nettó töltésük van, ami hozzájárul a negatív töltésű nukleinsavval való kölcsönhatásukhoz nukleozómák kialakításához..
Ismertek a nukleozomális és junkcionális vagy áthidalott hisztonok. A nukleoszomális hisztonok H3, H4, H2A és H2B, míg a kötő hisztonok a H1 hisztoncsaládhoz tartoznak.
A nukleozom összeszerelése során a H3-H4 és a H2A-H2B specifikus dimereket először alakítjuk ki. Ezután két H3-H4 dimert összekapcsolunk, hogy tetramereket képezzenek, amelyeket ezután a H2A-H2B dimerekkel kombinálunk, ami az oktamer központot képezi..
Valamennyi hisztont főként a sejtciklus S fázisában szintetizálnak, és a nukleozomokat a replikáló villa után közvetlenül a bejövő DNS hélixekbe szerelik össze..
struktúra
A hisztonok általános szerkezete magában foglal egy bázikus aminosav-régiót és egy erősen konzervált globuláris karboxil-régiót az eukarióta szervezetek között.
A "hiszton-hajtás" néven ismert szerkezeti motívum, amely három villával összekötött és egy kis hidrofób centrumot képez, felelős a fehérje-fehérje kölcsönhatásokért a nukleozomot alkotó hisztonok között..
Ez a hiszton-szeresedés az eukariótákban képezi az említett nukleoszomális fehérjék globuláris karboxil-doménjét..
A hisztonoknak kis "farka" vagy amino-terminális és más, a proteázokhoz hozzáférhető karboxil-terminális régiók is vannak, amelyek hossza legfeljebb 40 aminosav. Mindkét régió bázikus aminosavakban gazdag, amelyek több transzláció utáni kovalens módosítást végezhetnek.
Union hisztonok
Az eukariótákban az unió hisztonjainak két családja van, amelyeket struktúrájuk szerint differenciálnak. Némelyiknek háromoldalú szerkezete van, a fentiekben ismertetett gömbölyű domén N-és C-terminális "strukturálatlan" doménekkel; míg másoknak csak C-terminális tartománya van.
Bár a legtöbb hiszton konzerválódik, az embriogenezis vagy a speciális sejtek érlelése egyes organizmusokban bizonyos specifikus variánsokat okozhat. Néhány strukturális variáció a fordítást követő átalakításokhoz kapcsolódik:
-foszforiláció: feltételezhető, hogy a kromatin kondenzációs fokának módosításával kapcsolatos, és általában a szerinmaradékokban található.
-acetilezés: transzkripcionálisan aktív kromoszóma-régiókhoz kapcsolódik. Általában a lizinmaradékok oldalláncaiban fordul elő. Ezeknél a maradékoknál a pozitív töltés csökken, csökkenti a fehérjék affinitását a DNS-sel.
-metiláció: a fehérje magból kiálló lizinmaradékok mono-, di- vagy tri-metilaciónjaként adható meg.
A specifikus enzimek felelősek ezeknek a kovalens módosításoknak a hisztonokban történő előállításáért. Ezek az enzimek a hiszton-acetil-transzferázok (HAT), a hiszton-dezacetiláz-komplexek (HDAC-k) és a hiszton-metil-transzferázok és a demetilázok..
típus
A hisztonok jellemzését sokféle biokémiai módszerrel végeztük, amelyek közül a gyenge kationcserélő gyantákon alapuló kromatográfiák kiemelkednek.
Egyes szerzők olyan osztályozási eljárást hoznak létre, amelyben az eukariótákban 5 fő típusú hisztont különböztetünk meg: FI, 21 kDa fehérjével; F2A1 vagy FIV, plusz vagy mínusz 11,3 kDa; F2A2 vagy FIIbI, 14,5 kDa; F2B vagy FIIb2, amelynek molekulatömege 13,7 kDa, és F3 vagy FIII, 15,3 kDa.
Az ilyen típusú hisztonok, kivéve a FI csoportot, ekvimoláris mennyiségben találhatók a sejtekben.
Egy másik besorolás, ugyanolyan érvényességgel és talán a leginkább használt jelenleg, két különböző típusú hiszton létezését javasolja, nevezetesen azokat, amelyek a nukleozóm oktamer és a csomópont vagy híd hisztonok részét képezik, amelyek összekapcsolják a nukleoszomokat igen.
Bizonyos variánsok is előfordulhatnak a fajok között és ellentétben a nukleáris hisztonokkal, a variánsokat az interfész során szintetizáljuk, és az ATP hidrolíziséből felszabaduló energiától függő folyamaton keresztül az előformált kromatinba inszertáljuk..
Nukleoszomális hisztonok
A nukleozom magja a négy konstitutív hiszton mindegyikéből áll: H2a, H2b, H3 és H4; amelyen körülbelül 145 bázispár DNS-szegmensek vannak csomagolva.
A H4 és H2B hisztonok elvben változatlanok. Néhány variáció azonban nyilvánvaló a H3 és H2A hisztonokban, amelyek biofizikai és biokémiai tulajdonságai megváltoztatják a nukleoszom normális természetét..
A H2A.Z fehérje hiszton H2A egyik variánsának nagy savtartalma van, és elősegítheti a nukleozom stabilitását a hiszton H3 variánsoktól függően..
Ezek a hisztonok mutatnak némi változatosságot a fajok között, hiszen ez a H2B hiszton különleges esete, amelynél a molekula első harmada nagy mértékben változó..
Union hisztonok
A csomópont vagy híd hisztonok a H1 osztály hisztonjai. Ezek felelősek a nukleozomok és az egyes részecskék elején és végén kiemelkedő DNS védelemért.
A nukleoszomális hisztonokkal ellentétben a H1 típusú hisztonok nem rendelkeznek a hisztonok "hajtogatásának" globuláris régiójával. Ezek a fehérjék kötődnek a nukleozomok közötti DNS-hez, elősegítve a kromatin egyensúlyának változását egy kondenzáltabb és kevésbé aktív állapot felé, transzkripcionálisan beszélve.
A tanulmányok ezeket a hisztonokat az öregedés, a DNS-javítás és az apoptotikus folyamatokhoz kapcsolták, ezért úgy gondolják, hogy döntő szerepet játszanak a genomiális integritás fenntartásában.
funkciók
A hisztonok minden aminosav-csoportja valamilyen módon részt vesz a DNS-sel való kölcsönhatásban, ami megmagyarázza azt a tényt, hogy annyira konzerváltak az eukarióta szervezetek királyságai között.
A hisztonok kromatin formájában történő DNS-csomagolásában való részvétele nagy jelentőséggel bír a bonyolult többsejtű szervezetekben, amelyekben a különböző sejtvonalak csak a génjeik hozzáférhetőségének a transzkripciós gépre történő megváltoztatásával specializálódhatnak..
A transzkripciósan aktív genomi régiók sűrűek a nukleozomokban, ami arra utal, hogy a DNS és a hiszton fehérjék közötti kapcsolat döntő fontosságú a transzkripció negatív vagy pozitív szabályozásához..
Hasonlóképpen, egy sejt élettartama alatt a nagy számú belső és külső ingerre adott válasz a kromatin kis változásaitól függ, amelyek általában a transzlációs utólagos átalakítással és a hisztonok módosításával kapcsolatosak. szoros kapcsolat a DNS-sel.
Az eukariótákban több hisztonváltozó különböző funkciókat mutat. Ezek közül az egyik a H3 hiszton egyik változatának a kromoszómák szegregációjáért felelős centromer struktúrák kialakulásában való részvételével kapcsolatos..
Kimutatták, hogy ennek a fehérjének más eukariótákban a megfelelője a kinetochore fehérje összeszereléséhez, amelyhez az orsó-mikrotubulusok kötődnek a mitózis és a meiózis során..
referenciák
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., és Walter, P. (2015). A sejt molekuláris biológiája (6. kiadás). New York: Garland Tudomány.
- Campos, E. I. és Reinberg D. (2009). Hisztonok: a kromatin feljegyzése. Annu. Rev. Genet., 43, 559-599.
- Harvey, A. C., és Downs, J. A. (2004). Milyen funkciókat biztosít a linker hisztonok? Molecular Microbiology, 53, 771-775.
- Henikoff, S., és Ahmad, K. (2005). Változatos hisztonok összeszerelése a kromatinba. Annu. Rev. Cell. Dev. Biol., 21, 133-153.
- Isenberg, I. (1979). Hisztonokat. Annu. Biochem. 48, 159-191.
- Kornberg, R. D. és Thomas, J. O. (1974). Kromatin szerkezet: A hisztonok oligomerjei. Science, 184 (4139), 865-868.
- Smith, E., DeLange, R. és Bonner, J. (1970). A hisztonok kémia és biológiája. Physiological Reviews, 50 (2), 159-170.


