Az anyag jellemzői (fizikai és kémiai)
az az anyag jellemző tulajdonságai ezek kémiai vagy fizikai tulajdonságok, amelyek segíthetnek azonosítani vagy megkülönböztetni az egyik anyagot a másiktól. A fizikai tulajdonságok olyan tulajdonságok, amelyek az érzékekkel megfigyelhetők. A kémiai tulajdonságok olyan jellemzők, amelyek leírják, hogyan változik az anyag egy anyagról a másikra kémiai reakció során.
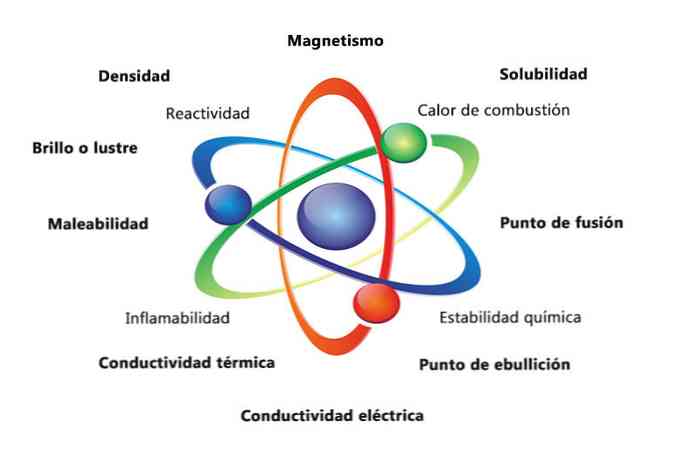
Az anyag néhány fizikai tulajdonsága a sűrűség, az oldhatóság, az olvadáspont, a szín és a tömeg. Az anyag kémiai tulajdonságai közé tartozik a gyúlékonyság, a savakkal való reakcióképesség és a korrózió. Néhány példa arra, hogy az anyag tulajdonságai hogyan tudnak azonosítani egy elemet, az összehasonlítani a különböző elemek sűrűségét.
Egy olyan elem, mint az arany sűrűsége 19,3 g / cm3, míg a kén sűrűsége 1,96 g / cm3. Hasonlóképpen az olyan anyagok, mint a víz és az izopropil-alkohol olvadáspontja eltérő.
Az anyag fizikai tulajdonságai
Az anyag fizikai tulajdonságai olyan tulajdonságok, amelyek mérhetők vagy megfigyelhetők az anyag kémiai jellegének megváltoztatása nélkül. Néhány példa a fizikai tulajdonságokra:
- Sűrűség: a tárgyat tartalmazó anyag mennyiségét úgy számítjuk ki, hogy a tömeget térfogatra osztjuk.
- Mágnesesség: a mágnes és a mágneses tárgy közötti vonzereje.
- Oldhatóság: annak mérése, hogy az anyag milyen mértékben oldódhat egy másik anyagban.
- Olvadáspont: hőmérséklet, amelynél az anyag szilárd anyagról folyadékra változik.
- Forráspont: hőmérséklet, amelyen az anyag folyadékról gázra változik.
- Elektromos vezetőképesség: azt mutatja meg, hogy az elektromos áramok milyen mértékben mozognak egy anyagon.
- Hővezetőképesség: az a sebesség, amellyel az anyag hőt szállít.
- Száríthatóság: az anyag gördülési vagy őrlési képessége különböző módon.
- Fényes vagy fényes: milyen könnyen tükrözi az objektum a fényt.
Az anyag kémiai tulajdonságai
A kémiai tulajdonságok az anyag azon képességét írják le, hogy egy új, különböző tulajdonságokkal rendelkező anyaggá alakuljon. Az alábbiakban néhány példa a kémiai tulajdonságokra:
- Az égés hője: az az energia, amely akkor szabadul fel, amikor egy vegyület oxigénnel teljes égésen megy keresztül.
- Kémiai stabilitás: arra utal, hogy egy vegyület vízzel vagy levegővel reagál-e (kémiailag stabil anyagok nem reagálnak).
- Gyúlékonyság: egy vegyület képessége láng hatásának kitett állapotban.
- Reaktivitás: egy másik anyaggal való kölcsönhatás képessége és egy vagy több új anyag képződése.
Az anyag fizikai állapota
Az anyag bármi, ami egy helyet foglal el, melynek tömege van, és amit érzékünk érzékel. Az anyag fizikai állapota szerint: szilárd, folyékony és gáz halmazállapotú.
1- Szilárd anyagok és jellemzői
Minden szilárd anyag tömege van, helyet foglal el, meghatározott térfogatú és alakú, nem tér át a térben, és nem lehet tömöríteni vagy merev formájú. Példaként: fa, könyvek, szivacsok, fémek, kövek stb..
A szilárd anyagokban a kis részecskék nagyon közel állnak egymáshoz, és érintik egymást. A részecskék annyira közel állnak egymáshoz, hogy nem tudnak sokat mozogni, nagyon kevés hely van közöttük.
2- Folyadékok és jellemző tulajdonságaik
Minden folyadéknak tömege van, egy helyet foglal el, meghatározott térfogatú, de nem meghatározott alakja van (mivel alkalmazkodnak a tartályhoz, ahol vannak), nagyon kis mértékben tömöríthetők, és át tudnak térni a térben. Például: víz, petróleum, olaj stb..
A folyadékokban az anyag kis részecskéi kicsit távolabb vannak egymástól, több hely van közöttük (a szilárd anyaghoz képest), és nem érintik egymást. Ezért a részecskék a terek között mozoghatnak, és más részecskékkel ütköznek és folyamatosan ütköznek.
3- A gázok és azok jellemző tulajdonságai
Minden gáz tömege van, helyet foglal el, nincs meghatározott térfogata vagy alakja, nagy mértékben tömöríthető és térbe kerülhet. Példaként említjük: hidrogén, oxigén, nitrogén, szén-dioxid, gőz stb..
A gázokban a kis részecskék sokkal távolabb vannak egymástól, sokkal több hely van a köztük (a folyadékokhoz képest), és nem érintik egymást. A részecskék maximális mozgásszabadsággal rendelkeznek, így más részecskékkel folyamatosan változnak és ütköznek.
Az anyag állapotának változása
Az anyagot szilárd állapotból folyékony állapotba konvertálhatjuk, és fordítva, és folyékony állapotból gázállapotba, és fordítva. Ez az átalakítás az anyag állapotának megváltoztatásának nevét veszi fel, és a hőmérséklet változásai szerint történik:
egyesülés
Az anyag állapotának változása a szilárd anyagról a folyadékra a hőmérséklet növekedésével. Ha szilárd anyagot melegítünk, a hő a részecskéket erőteljesebben rezegíti.
Az olvadáspont elérésekor a szilárd részecskéknek elegendő kinetikus energiájuk van ahhoz, hogy leküzdjék azokat a vonzási erőket, amelyek rögzített helyzetben tartják őket, és megszakadnak, hogy kis csoportokat képezzenek..
Forrás vagy párologtatás
A folyadékanyag állapotának változása gázhalmazállapotúvá a hőmérséklet növelésével. Ha folyékony anyagot melegítenek, a hő a részecskék gyorsabban mozognak.
A forráspont elérésekor a folyékony részecskék elegendő kinetikus energiával rendelkeznek ahhoz, hogy leküzdjék azokat a vonzási erőket, amelyek rögzített helyzetben tartják őket, és különálló gázalakú részecskékké válnak..
Fagyasztás vagy megszilárdulás
A folyadékanyag állapotának változása szilárdvá a hőmérséklet csökkenésével. Ha folyékony anyagot lehűtünk, részecskéi sok kinetikus energiát veszítenek. A fagyáspont elérésekor a részecskék megállnak, és rögzített helyzetben szilárd részecskékké rezegnek.
Cseppfolyósítás vagy kondenzáció
A gáz halmazállapotának változása folyadékká a hőmérséklet csökkenésével. Ha egy gáz halmazállapotú anyagot lehűtünk, részecskéi sok kinetikus energiát veszítenek, ami azt eredményezi, hogy folyékony részecskékké válnak.
szublimáció
Néhány anyag közvetlenül változik a szilárd állapotukból a gázállapotukba, vagy fordítva, anélkül, hogy a folyékony állapotban lennének. Amikor ezeket a szilárd anyagokat felmelegítik, részecskéik olyan gyorsan mozognak, hogy teljesen elválasztják a teljes képződő gőzt vagy gázt, és fordítva, amikor a folyamat gáz-halmazállapotból szilárd anyaggá alakul.
referenciák
- De Podesta, M. Az anyag tulajdonságainak megértése, 2. kiadás. Nagy-Britannia: Taylor és Francis.
- Goel A. Az anyag államai. Újdelhi: Discovery Kiadó.
- Moore J, Stanitski C. A molekuláris tudomány, 5. kiadás. Stamford: Cengage tanulás.
- Ramakrishna A. Az anyag jellege, 1. kiadás. Újdelhi: Prakashan Goyal testvérek.
- Reger D, Goode S, Ball D. Kémia. Alapelvek és gyakorlat, 3. kiadás. Kanada: Brooks / Cole, Cengage tanulás.
- Shapere D. Matter (fizika). A lap eredeti címe: accessscience.com.
- Singh L, Kaur M. Matter környezetünkben. India: S. Chand iskola.


