Kémiai egyenletek kiegyensúlyozása Módszerek és példák
az kémiai egyenletek kiegyensúlyozása azt jelenti, hogy az említett egyenletben lévő összes elemnek azonos számú atomja van mindkét oldalon. Ennek eléréséhez szükséges a kiegyenlítő módszerek alkalmazása a reakcióban részt vevő minden egyes fajhoz megfelelő sztöchiometrikus együtthatók hozzárendeléséhez..
A kémiai egyenlet a két vagy több anyag közötti kémiai reakció során bekövetkező jelképekkel való ábrázolás. A reagensek kölcsönhatásba lépnek egymással, és a reakció körülményeitől függően egy vagy több különböző vegyületet kapunk termékként..
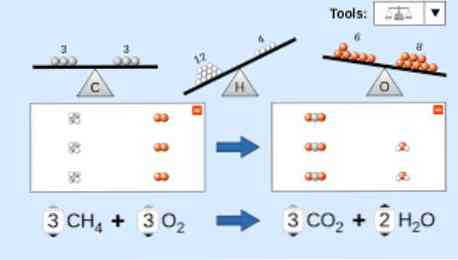
Egy kémiai egyenlet leírásakor figyelembe kell venni a következőket: Először is, a reagens anyagokat az egyenlet bal oldalán írjuk, majd egyirányú nyíl vagy két ellentétes vízszintes nyíl követ, attól függően, hogy milyen típusú reakciót hajtunk végre. köpeny.
index
- 1 A kémiai egyenletek kiegyensúlyozásának módszerei
- 1.1 Kémiai egyenletek egyenlege próba- és hibaelhárítással (ellenőrzéssel vagy tárgyalással is)
- 1.2 A kémiai egyenletek algebrai kiegyensúlyozása
- 1.3 A redox-egyenletek gördülése (ion-elektron-módszer)
- 2 Példák a kiegyensúlyozó kémiai egyenletekre
- 2.1 Az első példa
- 2.2 Második példa
- 2.3 Harmadik példa
- 3 Referenciák
A kémiai egyenletek kiegyensúlyozó módszerei
Alapul véve, hogy a reagensek és a termékek ismertek, és hogy képleteik helyesen vannak kifejezve az általuk megfelelő oldalon, folytatjuk az egyenletek egyensúlyát az alábbi módszerek szerint..
A kémiai egyenletek kiegyensúlyozása próba- és hibaelhárítással (ellenőrzéssel vagy próbával is hívható)
Ez a reakció sztöchiometriáján alapul, és megpróbál különböző koefficiensekkel próbálkozni az egyenlet kiegyensúlyozása érdekében, mindaddig, amíg a lehető legkisebb egész számot választják, amellyel mindkét elem azonos számú atomját kapjuk mindkét oldalon a reakciót.
A reagens vagy termék együtthatója a képlet előtti szám, és ez az egyetlen szám, amely az egyenlet kiegyenlítésekor megváltoztatható, mivel a képletek alszámainak megváltoztatása megváltoztatja a vegyület azonosságát. kérdéses.
Számolja és hasonlítsa össze
Miután azonosítottuk a reakció minden elemét, és a megfelelő oldalra helyeztük, folytatjuk az egyenletben lévő egyes elemek atomjainak számát és összehasonlítását, és meghatározzuk azokat, amelyeknek kiegyensúlyozottnak kell lenniük..
Ezután folytatjuk az egyes elemek kiegyensúlyozását (egyenként) azáltal, hogy minden olyan egyenletet tartalmazó teljes együtthatót helyezünk el, amely kiegyensúlyozatlan elemeket tartalmaz. Általában a fémes elemek kiegyensúlyozottak, majd a nemfémes elemek és végül az oxigén- és hidrogénatomok.
Ily módon minden egyes együttható megszorozza az előző képlet összes atomját; így egy elem kiegyensúlyozása közben a többiek kiegyensúlyozatlanságot okozhatnak, de ez kiigazításra kerül, mivel a reakció kiegyensúlyozott.
Végül, ezt megerősíti egy utolsó szám, hogy az egész egyenlet helyesen kiegyensúlyozott, vagyis az anyagmegőrzési törvényt betartja.
A kémiai egyenletek algebrai kiegyensúlyozása
Ennek a módszernek az alkalmazásához olyan eljárást hoznak létre, amely a megoldandó kémiai egyenletek együtthatóként kezelendő..
Először is, a reakció specifikus elemét referenciaként vesszük figyelembe, és az együtthatókat az (a, b, c, d ...) betűkkel helyezzük el, amelyek az egyes molekulák elemének meglévő atomjait (ha egy faj nem tartalmazza azt az elemet, hogy "0").
Az első egyenlet megszerzése után meghatároztuk a reakcióban lévő többi elem egyenleteit; annyi egyenlet létezik, mint amennyi elem van a reakcióban.
Végül az ismeretleneket a redukció, a kiegyenlítés vagy a szubsztitúció egyik algebrai módszere határozza meg, és az együtthatókat a megfelelő kiegyensúlyozott egyenlet eredményezi..
A redox-egyenletek kiegyensúlyozása (ion-elektron-módszer)
Először az általános (kiegyensúlyozatlan) reakciót ionos formába helyezzük. Ezután ezt az egyenletet két félreakcióra, az oxidációra és a redukcióra osztjuk, minden egyes egyensúlyt az atomok számának, típusának és ezeknek a terhelésének megfelelően osztva..
Például a savas közegben előforduló reakciókhoz H molekulákat adunk.2Vagy az oxigénatomok kiegyensúlyozása és H hozzáadása+ a hidrogénatomok kiegyensúlyozása.
Ezzel szemben egy lúgos közegben azonos számú OH-ionot adunk hozzá- mindegyik H ion egyenletének két oldalán+, és ahol H ionok keletkeznek+ és OH- összegyűlnek H-molekulák kialakítására2O.
Elektronok hozzáadása
Ezután hozzá kell adni annyi elektronot, amennyire szükséges, hogy egyensúlyba hozza a díjakat, miután egyensúlyba húzta az anyagot minden félreakcióban.
Az egyes félreakciók gördülését követően ezeket hozzáadjuk, és a végső egyenlet próbával és hibával történő kiegyensúlyozásával végződnek. Abban az esetben, ha a két félreakció elektronjainak száma különbözik, az egyiket vagy mindkettőt meg kell szorozni ezzel a számmal megegyező együtthatóval..
Végül meg kell erősíteni, hogy az egyenlet azonos számú atomot és azonos típusú atomot tartalmaz, ugyanakkor a globális egyenlet mindkét oldalán ugyanazok a díjak vannak.
Példák a kiegyensúlyozó kémiai egyenletekre
Első példa
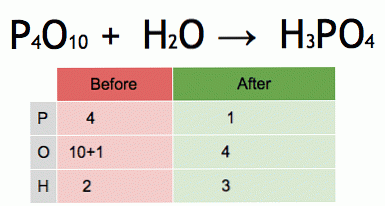
Ez egy kiegyensúlyozott kémiai egyenlet animációja. A foszfor-pentoxidot és a vizet foszforsavvá alakítjuk.
P4O10 + 6H20 → 4 H3PO4 (-177 kJ).
Második példa
Az etán égési reakciója (kiegyensúlyozatlan).
C2H6 + O2 → CO2 + H2O
A kiegyensúlyozásra szolgáló próba- és hibamódszer alkalmazásával megfigyelhető, hogy egyik elem sem azonos számú atomon van az egyenlet mindkét oldalán. Így a szénmérleggel kezdődik, és a termék oldalán mellékelt sztöchiometrikus együtthatóval kettőt adunk hozzá..
C2H6 + O2 → 2CO2 + H2O
A szén mindkét oldalon kiegyensúlyozott volt, így a hidrogén egyensúlyát a vízmolekulához három hozzáadásával folytatjuk.
C2H6 + O2 → 2CO2 + 3H2O
Végül, mivel az egyenlet jobb oldalán hét oxigénatom van, és ez az utolsó elem, amely még kiegyenlítendő, a 7/2 frakcionális szám az oxigén molekula elé kerül (bár általában előnyösek az egész együtthatók)..
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Ezután ellenőrizze, hogy az egyenlet mindkét oldalán azonos számú szénatom (2), hidrogén (6) és oxigén (7) van-e..
Harmadik példa
A vas dichromát-ionokkal történő oxidációja savas közegben történik (kiegyensúlyozatlan és ionos formában)..
hit2+ + Cr2O72- → Hit3+ + Cr3+
Az ion-elektron módszerrel kiegyensúlyozására két félreakcióra oszlik.
Oxidáció: Hit2+ → Hit3+
Csökkentés: Cr2O72- → Cr3+
Mivel a vas atomok már kiegyensúlyozottak (1: 1), a termékek oldalára egy elektron kerül a töltés kiegyensúlyozására.
hit2+ → Hit3+ + és-
Most a Cr atomjai kiegyensúlyozottak, kettőt adva az egyenlet jobb oldalához. Ezután, amikor a reakciót savas közegben hajtjuk végre, hét H molekulát adunk hozzá.2Vagy a termékek oldalán, hogy egyensúlyba hozza az oxigénatomokat.
Cr2O72- → 2Cr3+ + 7H2O
A H atomok kiegyensúlyozásához tizennégy H iont adunk hozzá+ a reaktánsok oldalán, és az anyag kiegyenlítése után a töltéseket ugyanazon az oldalon hat elektron hozzáadásával kiegyensúlyozzák.
Cr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Végül mindkét félreakció hozzáadásra kerül, de mivel az oxidációs reakcióban csak egy elektron van, mindezt hatszorosára kell szorozni..
6Fe2+ + Cr2O72- +14H+ + 6e- → Hit3+ + 2Ch3+ + 7H2O + 6e-
Végül az elektronokat a globális ionos egyenlet mindkét oldalán el kell távolítani, ellenőrizve, hogy a töltésük és az anyaguk helyesen kiegyensúlyozott-e.
referenciák
- Chang, R. (2007). Kémia. (9. kiadás). McGraw-Hill.
- Hein, M. és Arena, S. (2010). Főiskolai kémia alapjai, alternatív. A következőt kapta: books.google.co.ve
- Tuli, G. D. és Soni P. L. (2016). A kémia vagy a kémiai egyenletek nyelve. A következőt kapta: books.google.co.ve
- Speedy Publishing (2015). Kémiai egyenletek és válaszok (Speedy Study Guides). A következőt kapta: books.google.co.ve


