Nátrium-bromid (NaBr) kémiai szerkezete, tulajdonságai és felhasználásai
az nátrium-bromid olyan vegyi anyag, amely a szervetlen eredetű sókhoz tartozik. Szerkezete a bróm-halogénből és a nátrium-fémelemből áll 1: 1 arányban. Kémiai képlete NaBr, és szilárd állapotban van szilárd hőmérsékleten és nyomáson (25 ° C és 1 atm)..
Általában fehér por formájában figyelhető meg, és kristályos típusú vegyületnek tekinthető, amely szintén higroszkópos viselkedést mutat; vagyis képes nedvességet elnyelni a környezetéből.

Hasonlóképpen, a nátrium-bromid fizikai jellemzői nagyon hasonlítanak egy másik ugyanolyan fém: nátrium-klorid ionos vegyületéhez. Ezt a kloridot NaCl-ként ábrázoljuk, amely közismert nevén közönséges só vagy asztali só.
Számos felhasználási területe van a tudomány különböző területein; például különböző típusú gyógyszerek (nyugtatók, hipnotikumok, görcsoldó szerek), valamint szerves szintézisek és még a fotóalkalmazások esetében is felhasználhatók..
index
- 1 Kémiai szerkezet
- 1.1 Kémiai szintézis
- 2 Tulajdonságok
- 3 Használat
- 4 Referenciák
Kémiai szerkezet
Amint azt korábban említettük, a nátrium-bromid a szilárd fázisban fordul elő, és sok más szervetlen természetű sóhoz hasonlóan kristályos szerkezeti konformáció van..
Ez a kristályos molekula, amely egy brómatomból és egy hidrogénatomból áll, egy kubikus típusú konformációval rendelkezik, amely az arcokra koncentrálódik, mint például az ugyanazon fém (NaI, NaF és NaCl) halogén sói..
Ez a molekuláris elrendezés számos vegyület szerkezeti alapját képezi, amelyekben a megrendelést úgy hajtjuk végre, hogy minden egyes ionot egy oktaéderes alak közepén tartsanak, amint az a következő képen látható..
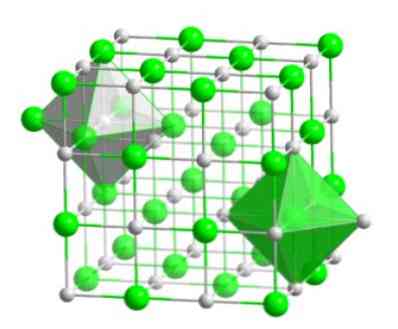
Az ilyen típusú kristályokban láthatjuk, hogy az ionok mindegyikében hat másik ion van - amelyeknek az ellentétes elektromos töltése van -, amelyek az oktaéderes alak végén találhatók..
Ennek az ionos anyagnak a szerkezete azt is jelenti, hogy magas olvadáspontja körülbelül 747 ° C, kereskedelmi forgalomban két formában: vízmentes faj (vízmolekulák nélkül) és egy dihidrált faj (két vízmolekulával együtt). Strukturális képlet (NaBr · 2H2O)), amelyek olvadáspontjai eltérőek.
Kémiai szintézis
A nátrium-bromidot a hidrogén-bromid (BrH, hidrogén-halogenid gázfázisban) és a nátrium-hidroxid (NaOH, szilárd fázisú, erős higroszkópos tulajdonságú nátrium-hidroxid) kémiai reakciója okozza..
Ily módon kereskedelmi forgalomban állítjuk elő, ha a nátrium-hidroxid oldatához feleslegben brómot adunk. Ez bromid / bróm keveréket képez. Ezt követően a kapott termékeket bepárlással szárítjuk, majd szárítjuk és szénnel kezeljük a bróm-ion redukciós reakcióját (BrO3-) a bromidionhoz (Br-).
ellenhatás
Hasonlóképpen ez a szervetlen só nátrium-karbonát semlegesítési reakciójával (Na2CO3) brómsavval (HBrO)3) a fent leírt eljárás szerint.
Szintézis révén ez az anyag előállítható a vas és a bróm közötti reakcióval. E reakció eredményeként a vas-vas-bromid fajok származnak.
Ezt követően ez a faj képződött (mint FeBr2/ FeBr3) feloldjuk vízben, és bizonyos mennyiségű nátrium-karbonátot adunk hozzá. Végül az oldatot leszűrjük, és bepároljuk, hogy végül megkapjuk a nátrium-bromidot.
tulajdonságok
- Gyakran megtalálható szilárd aggregáció állapotában, fehér por formájában.
- Kristályos szerkezetű, kocka alakú molekuláris elrendezése, amely az arcokra koncentrál.
- Ennek az anyagnak az olvadáspontja körülbelül 747 ° C a vízmentes formában és 36 ° C a dihidrátos formában, amely felbomlik, mielőtt elolvad.
- Ez egy nátriumionból (Na+) és bromid-ion (Br-), amelynek moláris tömege vagy molekulatömege 102,89 g / mol.
- Forráspontja meglehetősen magas, 1390 ° C-on (2530 ° F vagy 1660 K).
- Ennek a fajnak az oldhatósága körülbelül 94,32 g / 100 ml 25 ° C-os vízben, növekvő hőmérséklet mellett.
- Ha az anyag bomlik, akkor az anyag bomlástermékeket és nátrium-oxidokat bocsát ki mérgezőnek.
- A nátrium-bromid vízmentes formájának sűrűsége 3,21 g / cm3, míg a dihidrátvegyület 2,18 g / cm33.
- Alkoholban való oldhatósága mérsékeltnek tekinthető, mint más oldószerekben, például piridinben, ammóniában és hidrazinban.
- Oldhatatlan az acetonitril és az aceton ellen.
alkalmazások
- Az orvostudomány területén drogként alkalmazzák rohamot okozó betegségek és az epilepszia megelőzésére szolgáló terápiát Wolf-Hirschhorn szindrómában szenvedő betegekben, valamint nyugtató és hipnotikus kezelésben..
- Az állatgyógyászatban olyan kutyáknál alkalmazzák, amelyeknél a gyógyszerek, például a fenobarbitál vagy a primidon mellékhatásai miatt görcsrohamok lépnek fel..
- Az olajipar területén az olajkútokban használt, különböző sűrűségű folyadékok előkészítési folyamatait használják.
- A biológiai kutatás területén bebizonyosodott, hogy mikrobiocid tulajdonságai; azaz különböző baktériumok fejlődésének szabályozására használják.
- A szerves típusú egyes szintézisekben ez a szervetlen természetű só más, bróm által alkotott fajok előállítására szolgál. Például a Finkelstein reakciójával néhány nagyobb reaktivitással rendelkező alkil-halogenidet kapunk, amelyek közül az egyik a fotográfiában használták..
- A tisztítás és fertőtlenítés területén a nátrium-bromidot klórral kombinálva használják nagy mennyiségű víz tisztítására, például úszómedencékben és jacuzziban..
referenciák
- Wikipedia. (N.d.). Nátrium-bromid. A (z) en.wikipedia.org webhelyről származik
- Pubchem. (N.d.). Nátrium-bromid. A pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Meghívás a szerves kémia. A következőt kapta: books.google.co.ve
- Science Direct. (N.d.). Nátrium-bromid. A (z) sciencedirect.com webhelyről származik
- Riviere, J. E. és Papich, M. G. (2009). Állatorvosi farmakológia és gyógyászat. A következőt kapta: books.google.co.ve


