Ketonok típusok, tulajdonságok, nómenklatúra, felhasználások és példák
az ketonok ezek szerves vegyületek, amelyek karbonilcsoportot tartalmaznak (-CO). Ezek olyan egyszerű vegyületek, amelyekben a karbonilcsoport szénatomja két szénatomhoz kapcsolódik (és ezek szubsztituensláncaihoz). A ketonok "egyszerűek", mert nem rendelkeznek reaktív csoportokkal, mint a -OH vagy -Cl, amelyek a szénhez kapcsolódnak.
Végül, a ketonok eltávolítása az emberi testből általában alacsony cukorszinttel (diabéteszes esetekben és / vagy extrém böjtölés) társul, ami súlyos egészségügyi problémákat okozhat a betegnek.
index
- 1 A ketonok általános képlete
- 2 A ketonok típusai
- 2.1 A lánc szerkezetének megfelelően
- 2.2 A radikálisok szimmetriája szerint
- 2.3 A radikálisok telítettsége alapján
- 2.4. Dicetonok
- 3 A ketonok fizikai és kémiai tulajdonságai
- 3.1 Forráspont
- 3.2 Oldhatóság
- 3.3 Savasság
- 3.4 Reaktivitás
- 4 Nómenklatúra
- 5 Az aldehidek és a ketonok közötti különbség
- 6 Ipari és mindennapi élet
- 7 Példák a ketonokra
- 7.1 Butanon (C4H8O)
- 7.2 Ciklohexanon (C6H10O)
- 7.3 A tesztoszteron (C19H22O2)
- 7.4 Progesteron (C21H30O2)
- 8 Hivatkozások
A ketonok általános képlete
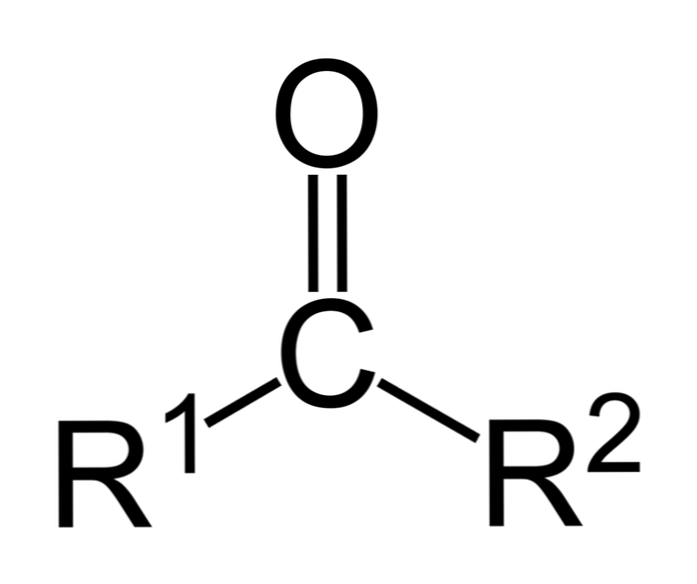
A ketonok olyan karbonilvegyületek, amelyekben ez a csoport két szénhidrogéncsoporthoz kapcsolódik; ezek lehetnek alkilcsoportok, benzolgyűrűcsoportok vagy mindkettő.
Egy ketont lehet képviseli egyszerűen R- (C = O) -R „ahol R és R” jelentése vagy két szénhidrogénláncot (alkánok, alkének, alkinek, cikloalkánok, benzol-származékok és mások). A karbonilcsoporthoz kapcsolódó hidrogénnel nincsenek ketonok.
A ketonok ipari és laboratóriumi környezetben történő előállítására számos módszer létezik; Ezenkívül fontos megjegyezni, hogy a ketonokat különböző szervezetek, így az emberek is szintetizálhatják.
Az iparban a ketonok szintézisének leggyakoribb módszere a szénhidrogének oxidációja, jellemzően a levegő felhasználásával. Kis mennyiségben a ketonokat általában másodlagos alkoholok oxidálásával állítják elő, amelyek termékként ketont és vizet adnak..
A leggyakoribb módszereken kívül a ketonok alkének, alkinok, nitrogénvegyületek sói, észterek és sok más vegyület szintetizálhatók, ami megkönnyíti azok előállítását..
A ketonok típusai
A ketonok több osztályozásban vannak, elsősorban az R láncukban lévő szubsztituensektől függően. Az alábbi anyagok a leggyakoribb besorolások:
A lánc szerkezetének megfelelően
Ebben az esetben, a ketont van besorolva a módot, ahogyan az strukturálva lánc: alifás ketonok azok, amelyek két R és R „csoportok, amelyek alkil gyökök képződnek (alkánok, alkének, alkinek és cikloalkánok).
Az aromás vegyületek benzolszármazékokat képeznek, miközben ketonok maradnak. Végül vegyes ketonok azok, amelyek R alkilcsoportot és R 'arilcsoportot tartalmaznak, vagy fordítva.
A radikálisok szimmetriája szerint
Ebben az esetben a karbonilcsoport R és R 'csoportjainak szubsztituenseit tanulmányozzuk; ha ezek azonosak (azonosak), a ketont szimmetrikusnak nevezik; de ha különbözőek (mint a legtöbb keton), ezt aszimmetrikusnak nevezik.
A radikálisok telítettsége szerint
A ketonok a szénláncaik telítettsége szerint is osztályozhatók; Ha ezek alkánok formájában vannak, a ketont telített ketonnak nevezzük. Ezzel szemben, ha a láncokat alkének vagy alkinok formájában találjuk, a ketont telítetlen ketonnak nevezzük.
diketonok
Ez a keton külön osztálya, mivel ennek a ketonnak a láncai szerkezetben két karbonilcsoportot tartalmaznak. Ezeknek a ketonoknak egy része egyedi tulajdonságokkal rendelkezik, mint például a szén közötti hosszabb kötés.
Például a ciklohexánból származó diketonokat kinonoknak nevezik, amelyek csak kettő: orto-benzokinon és para-benzokinon.
A ketonok fizikai és kémiai tulajdonságai
A ketonok, mint a legtöbb aldehid, folyékony molekulák, és számos olyan fizikai és kémiai tulajdonsággal rendelkeznek, amelyek a láncaik hosszától függenek. Tulajdonságai a következők:
Forráspont
Ketonok, erősen illékonyak, lényegében poláros és nem adhatnak hidrogén hidrogénkötések (nem rendelkeznek hidrogénatom kapcsolódik a karbonil-csoport), így a jelen pontok magasabb alkének és éterek forrásban lévő, de alacsonyabb, mint azonos molekulatömegű alkoholok.
A keton forráspontja növekszik a molekula méretének növekedésével. Ennek oka a van der Waals erők és a dipol-dipol erők beavatkozása, amelyek nagyobb energiát igényelnek a molekulához vonzódó atomok és elektronok elválasztásához..
oldhatóság
A ketonok oldhatósága erősen befolyásolja részben ezen molekulák azon képességét, hogy az oxigénatomban hidrogént fogadjanak, és így hidrogénkötést képeznek vízzel. Ezen kívül vonzó, szóró és dipol-dipol erők képződnek a ketonok és a víz között, ami növeli az oldható hatásukat.
A ketonok elvesztik az oldhatóságot, annál nagyobbak a molekulájuk, mivel a vízben való feloldódáshoz több energiát igényelnek. Szerves vegyületekben is oldódnak.
savanyúság
Karbonil-csoportjának köszönhetően a ketonok savas természetűek; ez azért fordul elő, mert ennek a funkcionális csoportnak a rezonanciastabilizációs kapacitása miatt a protonokat át lehet vinni kettős kötéséből, hogy konjugált bázist képezzen, az enolnak nevezve..
reakcióképesség
A ketonok számos szerves reakció részét képezik; ez a karbonil-szénnek a nukleofil addícióra való érzékenysége miatt következik be, ezen kívül a polaritás mellett..
Amint azt fentebb említettük, a ketonok nagy reaktivitása olyan elismert köztes termékké teszi őket, amely alapul szolgál más vegyületek előállításához.
nómenklatúra
Ketonok elnevezése a prioritás vagy fontosságát a karbonilcsoport az egész molekulában, így amikor egy molekula által szabályozott a karbonilcsoport, a ketont megnevezett hozzáadásával az utótag „-on” a neve a szénhidrogén.
A legnagyobb láncot a karbonilcsoporttal a fő láncnak tekintjük, majd a molekulát nevezzük el. Ha a karbonilcsoport nem rendelkezik elsőbbséggel a molekula többi funkcionális csoportjával szemben, akkor azt "-oxo" -val azonosítjuk..
Bonyolultabb ketonok helyzetének azonosítását a funkciós csoport egy számot, és abban az esetben a diketonokat (ketonok két szubsztituens R és „azonos R), a molekula, amelyek neve a utótag»-dion«.
Végül a "keton" szót is alkalmazhatjuk a karbonilcsoporthoz kapcsolódó csoportok láncainak azonosítását követően.
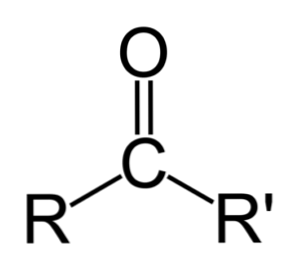
Az aldehidek és a ketonok közötti különbség
A legnagyobb különbség az aldehidek és a ketonok között a hidrogénatom jelenléte az aldehidek karbonilcsoportjához kapcsolódik..
Ez az atom fontos hatással van egy molekula bevonására oxidációs reakcióba: az aldehid karbonsavat vagy karbonsav-sót képez, attól függően, hogy az oxidáció savas vagy bázikus körülmények között történik-e..
Ezzel szemben a ketonnak nincs ilyen hidrogénje, így az oxidációhoz szükséges minimális lépések nem fordulnak elő.
Vannak módszerek a keton oxidálására (oxidálószerekkel sokkal erősebbek, mint a tipikusan használtak), de ezek megszakítják a ketonmolekulát, először két vagy több részre osztva..
Ipari és mindennapi élet
Az iparágban a ketonokat gyakran megfigyelik a parfümökben és a festékekben, a stabilizátorok és a tartósítószerek szerepét, amelyek megakadályozzák a keverék más összetevőinek lebomlását; széles spektrumúak, mint oldószerek azokban az iparágakban, amelyek robbanóanyagokat, festékeket és textileket gyártanak a gyógyszerek mellett.
Az aceton (a legkisebb és legegyszerűbb keton) egy világszerte ismert oldószer, amelyet festékeltávolító és hígítószerként használnak..
A ketonok természetüknél fogva cukrokként jelennek meg, úgynevezett ketózok. A ketózisok olyan monoszacharidok, amelyek molekulánként egy ketont tartalmaznak. A legismertebb ketóz a fruktóz, a gyümölcsökben található cukor és a méz.
Az állati sejtek citoplazmájában bekövetkező zsírsav-bioszintézis a ketonok hatására is előfordul. Végül, és amint azt fentebb említettük, a vérben a ketonok felemelkedhetnek éhgyomorra vagy cukorbeteg esetekben.
A ketonok példái
Butanon (C4H8O)
A MEK (vagy MEC) néven is ismert, ezt a folyadékot nagy mennyiségben gyártják az iparban és oldószerként használják.
Ciklohexanon (C6H10O)
A nagy mennyiségben előállított ketont a szintetikus nylon anyag prekurzoraként használják.
Tesztoszteron (C19H22O2)
Ez a férfi nemi és az anabolikus szteroidok fő hormonja, amelyet a legtöbb gerincesben találtak.
Progeszteron (C21H30O2)
Endogén szteroid és nemi hormon, amely a menstruációs ciklusban, a terhességben és az embriogenezisben részt vesz az emberekben és más fajokban.
referenciák
- Wikipedia. (N.d.). Keton. A (z) en.wikipedia.org webhelyről származik
- Britannica, E. (s.f.). Keton. A britannica.com-ból származik
- Egyetem, M. S. (s.f.). Aldehidek és ketonok. A kémia.msu.edu-ból származik
- ChemGuide. (N.d.). Aldehidek és ketonok bemutatása. A kemguide.co.uk-ból származik
- Calgary, U. O. (s.f.). Ketonok. A kem.ucalgary.ca


