Etánszerkezet, tulajdonságok, felhasználások és kockázatok
az etán egy egyszerű (C) általános képletű szénhidrogén2H6 színtelen és szagtalan gáz jellegű, az etilén szintézisében igen értékes és változatos felhasználású. Ezenkívül az egyik földi gáz, amelyet más bolygókon és csillagfelületeken is észleltek a Naprendszer körül. 1834-ben felfedezte Michael Faraday tudós.
A szén- és hidrogénatomok (szénhidrogének) által alkotott nagyszámú szerves vegyület közül olyanok vannak, amelyek hőmérsékleten és környezeti nyomáson gázállapotban vannak, és amelyeket sok iparágban használnak..
Ezek rendszerint a "földgáz" -nak nevezett gáznemű keverékből származnak, amely nagy értéket jelent az emberiség számára, és metán, etán, propán és bután között, többek között; a láncban lévő szénatomok mennyiségének megfelelően osztályozzák.
index
- 1 Kémiai szerkezet
- 1.1 Etán szintézise
- 2 Tulajdonságok
- 2.1 Az etán oldhatósága
- 2.2 Az etán kristályosodása
- 2.3 Az etán égése
- 2.4 Az etán a légkörben és az égi testekben
- 3 Használat
- 3.1. Etiléngyártás
- 3.2 Az alapvető vegyi anyagok képzése
- 3.3 Hűtőközeg
- 4 Az etán kockázatai
- 5 Referenciák
Kémiai szerkezet
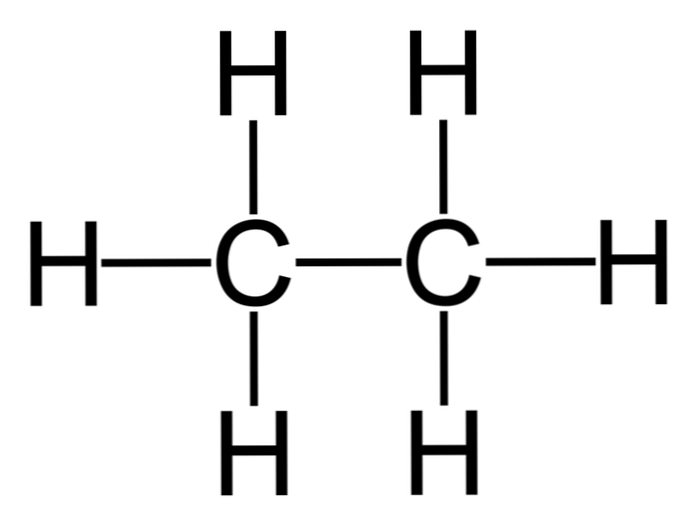
Az etán egy molekula, amelynek képlete C2H6, jellemzően két metilcsoport (-CH3) egy egyszerű szén-szén kötés szénhidrogénjének kialakítására. A metán után is a legegyszerűbb szerves vegyület, amely a következőképpen jelenik meg:
H3C-CH3
A molekula szénatomjai sp-hibridizációval rendelkeznek3, így a molekuláris kötések szabadon forognak.
Továbbá létezik az etán belső jelensége is, amely a molekuláris szerkezet forgatásán alapul, és a minimális energiával, ami a 360 fokos kötés forgatásához szükséges, amit a tudósok "etángátnak" neveztek..
Ebből az okból az etán különböző alakzatokban fordulhat elő, annak ellenére, hogy stabilabb konformációja létezik, ahol a hidrogének egymással szemben vannak (az ábrán látható).

Etán szintézise
Az etánt könnyen szintetizálhatjuk Kolbe elektrolíziséből, amely szerves lépés, két lépésben: elektrokémiai dekarboxilezés (karboxilcsoport eltávolítása és szén-dioxid kibocsátás) két karbonsavból és a termékek kombinációja. köztitermékek kovalens kötést képeznek.
Hasonlóképpen, az ecetsav elektrolízise az etán és a szén-dioxid képződéséhez vezet, és ezt a reakciót az első szintetizálására használják..
Az ecetsavanhidrid peroxidok hatására történő oxidálása, amely hasonló a Kolbe elektrolíziséhez, szintén etán képződéséhez vezet..
Hasonlóképpen, hatékonyan elválasztható a földgáztól és a metántól cseppfolyósítási eljárással, kriogén rendszerek alkalmazásával, hogy ezt a gázt rögzítsék és elkülönítsék a más gázokkal való keverékektől..
Ennek a szerepnek a előnyös a turbófejlődési eljárás: a gázkeveréket egy turbinán vezetjük át, és ennek következtében a hőmérséklete -100ºC alá csökken..
Már ezen a ponton a keverék összetevői megkülönböztethetők, így a folyékony etánt elválasztjuk a gáz-halmazállapotú metántól és a többi fajtól, amely a desztilláció használatával jár..
tulajdonságok
Az etán a természetben szagtalan és színtelen gázként jelentkezik standard nyomáson és hőmérsékleten (1 atm és 25 ° C). Forráspontja -88,5 ° C, olvadáspontja -182,8 ° C. Ezenkívül nem befolyásolja az erős savak vagy bázisok expozíciója.
Etanol oldhatóság
Az etán molekulái szimmetrikusan vannak kialakítva és gyengén vonzódó erőkkel rendelkeznek, amelyek együtt tartják őket, az úgynevezett diszperziós erők.
Amikor az etánt vízben oldják meg, a gáz és a folyadék között kialakult vonzódási erők nagyon gyengék, így nagyon nehéz az etánt vízmolekulákkal összekapcsolni.
Ezért az etán oldhatósága jelentősen alacsony, enyhén emelkedik, amikor a rendszer nyomása emelkedik.
Etán kristályosodása
Az etán megszilárdulhat, ezáltal instabil etánkristályok képződnek, amelyek köbös kristályos szerkezetűek.
A -183,2 ° C-ot meghaladó hőmérséklet csökkenés esetén ez a szerkezet monoklinikusvá válik, növelve molekulájának stabilitását.
Etán égés
Ez a szénhidrogén, annak ellenére, hogy nem széles körben használják tüzelőanyagként, felhasználható az égési folyamatokban szén-dioxid, víz és hő előállítására, amely a következőképpen jelenik meg:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
Az is lehetséges, hogy ezt a molekulát felesleges oxigén nélkül égetjük, amely "nem teljes égés" néven ismert, és amorf szén és monoxid képződését eredményezi egy nem kívánt reakcióban, az alkalmazott oxigén mennyiségétől függően. :
2C2H6 + 3O2 → 4C + 6H2O + hő
2C2H6 + 4O2 → 2C + 2CO + 6H2O + hő
2C2H6 + 5O2 → 4CO + 6H2O + hő
Ezen a területen az égés a szabad gyökök reakcióinak sorozatán keresztül történik, amelyek a több száz különböző reakcióban vannak számozva. Például olyan vegyületek, mint a formaldehid, az acetaldehid, a metán, a metanol és az etanol képződhetnek hiányos égési reakciókban..
Ez attól függ, hogy milyen körülmények között történik a reakció és a szabad gyökök reakciói. Az etilén magas hőmérsékleten (600-900 ° C) is képződhet, ami az ipar által nagyon kívánatos termék.
Etán a légkörben és az égi testek
Az etán a Föld bolygó atmoszférájában nyomokban jelen van, és gyanítható, hogy az embernek sikerült megduplázni ezt a koncentrációt, miután ipari tevékenységet kezdett gyakorolni.
A tudósok úgy vélik, hogy a légkörben jelen lévő etán jelenlétének nagy része a fosszilis tüzelőanyagok elégetésének köszönhető, bár a globális gázkibocsátás csaknem felére csökkent, mivel a palagáz-termelési technológiák javultak (a földgázforrás).
Ezt a fajt természetesen a napsugarak atmoszférikus metánra gyakorolt hatása okozza, amely rekombinál és képez etán molekulát..
Az etán folyékony állapotban van a Titan felszínén, az egyik Saturnus holdja. Ez nagyobb mennyiségben fordul elő a Vid Flumina folyóban, amely több mint 400 kilométerre áramlik az egyik tengeréhez. Ezt a vegyületet az üstökösökön és a Plutó felületén is bizonyították.
alkalmazások
Etilén termelés
Az etán felhasználása főként az etilén termelésén alapul, amely a világ termelésében leggyakrabban használt ökológiai termék, gőzkrakkolással ismert folyamaton keresztül..
Ez az eljárás etánnal hígított etán táplálékának a sütőbe történő eljuttatását jelenti, gyorsan melegítve, oxigén nélkül.
A reakció rendkívül magas hőmérsékleten történik (850 és 900 ° C között), de a tartózkodási idő (az etán által töltött idő a sütőben belül) rövid, hogy a reakció hatékony legyen. Magasabb hőmérsékleten több etilén keletkezik.
Az alapvető vegyi anyagok képzése
Az etánt is tanulmányozták, mint az alapvető vegyi anyagok kialakításának fő összetevőjét. Az oxidatív klórozás az egyik olyan eljárás, amelyet a vinil-klorid (egy PVC komponens) előállítására javasolt, a kevésbé költséges és bonyolultabb anyagokat helyettesítve..
hűtő
Végül az etánt hűtőközegként használják a közös kriogén rendszerekben is, ami azt is mutatja, hogy a laboratóriumban kis mennyiségű mintát lehet fagyasztani elemzés céljából..
Nagyon jó helyettesíti a vizet, amely hosszabb időt vesz igénybe a finom minták lehűlésére, és káros jégkristályok képződését is eredményezheti..
Etán kockázatok
-Az etán meggyullad, különösen akkor, ha levegővel kötődik. A levegőben lévő 3,0–12,5 térfogatszázalék etán százalékban robbanékony keverék keletkezhet.
-Ez korlátozhatja az oxigént a levegőben, amelyben megtalálható, és ezért kockázati tényezője a fulladásnak a jelenlévő és kitett embereknek és állatoknak..
-A fagyasztott folyadék formában lévő etán súlyosan égheti a bőrt, ha közvetlen érintkezésbe kerül vele, és kriogén közegként is működik minden olyan tárgyhoz, amelyet érint, és pillanatnyilag befagyasztja..
-A folyékony etán gőzei nehezebbek, mint a levegő, és a földön koncentrálódnak, ez a gyulladás kockázatát okozhatja, ami lánc égési reakciót eredményezhet..
-Az etán lenyelése hányingert, hányást és belső vérzést okozhat. A belégzés a fulladás mellett fejfájást, zavart és hangulati ingadozást okoz. A szívmegállásból eredő halál nagy expozíció esetén lehetséges.
-Ez egy olyan üvegházhatású gáz, amely a metánnal és a szén-dioxiddal együtt hozzájárul az emberi szennyezés által okozott globális felmelegedéshez és az éghajlatváltozáshoz. Szerencsére kevésbé bőséges és tartós, mint a metán, és ez kevesebb sugárzást visz fel.
referenciák
- Britannica, E. (s.f.). Az etán. A britannica.com-ból származik
- Nes, G. V. (s.f.). Az etán, az etilén és az acetilén egykristályos szerkezete és elektron-sűrűség-eloszlása. A rug.nl
- Sites, G. (s.f.). Etán: források és mosogatók. Letöltve a sites.google.com webhelyről
- SoftSchools. (N.d.). Etán képlet. A softschools.com webhelyről helyreállították
- Wikipedia. (N.d.). Az etán. A (z) en.wikipedia.org webhelyről származik


