Kalcium-foszfát (Ca3 (PO4) 2) szerkezete, tulajdonságai, kialakulása és felhasználása
az kalcium-foszfát egy szervetlen és tercier só, amelynek kémiai képlete Ca3(PO4)2. A képlet szerint a só összetétele kalcium és foszfát esetében 3: 2. Ez közvetlenül az alsó képen látható, ahol a Ca-kation látható2+ és az anion PO43-. Minden három Ca-ra2+ Két PO van43- kölcsönhatásba lépnek velük.
Másrészt a kalcium-foszfát egy olyan só-sorozatra utal, amely a Ca / P aránytól függően változik, valamint a hidratáció és a pH mértéke. Valójában sokféle kalcium-foszfát létezik és szintetizálható. A nomenklatúrát követve azonban a kalcium-foszfát csak a fent említett trikalciumra vonatkozik.

Minden kalcium-foszfát, beleértve a Ca-t is3(PO4)2, Ezek fehér színűek, enyhén szürkés színekkel. Ezek lehetnek szemcsés, finom, kristályosak és részecskeméreteik, amelyek mikrométer körül vannak; és még ezeknek a foszfátoknak a nanorészecskéit is elkészítették, amelyekkel a csontok biokompatibilis anyagait tervezték.
Ez a biokompatibilitás annak a ténynek köszönhető, hogy ezek a sók megtalálhatók a fogakban, és röviden az emlősök csontszövetében. Például a hidroxi-apatit egy kristályos kalcium-foszfát, amely viszont kölcsönhatásba lép az azonos só amorf fázisával..
Ez azt jelenti, hogy léteznek amorf és kristályos kalcium-foszfátok. Emiatt a sokféleség és a több lehetőség nem meglepő a kalcium-foszfátokon alapuló anyagok szintetizálásakor; olyan anyagok, amelyek tulajdonságait a kutatók naponta jobban érdeklik, hogy a csontok helyreállítására összpontosítsanak.
index
- 1 A kalcium-foszfát szerkezete
- 1.1 Amorf kalcium-foszfát
- 1.2 A család többi része
- 2 Fizikai és kémiai tulajdonságok
- 2.1 Nevek
- 2.2 Molekulatömeg
- 2.3 Fizikai leírás
- 2.4 Íze
- 2.5 Olvadáspont
- 2.6 Oldhatóság
- 2.7 Sűrűség
- 2.8 Törésmutató
- 2.9 A képzés standard entalpiája
- 2.10 Tárolási hőmérséklet
- 2,11 pH
- 3 Képzés
- 3.1 Kalcium-nitrát és ammónium-hidrogén-foszfát
- 3.2 Kalcium-hidroxid és foszforsav
- 4 Felhasználások
- 4.1 A csontszövetben
- 4.2 Biokerámiai cementek
- 4.3 Az orvosok
- 4.4 Egyéb
- 5 Referenciák
A kalcium-foszfát szerkezete
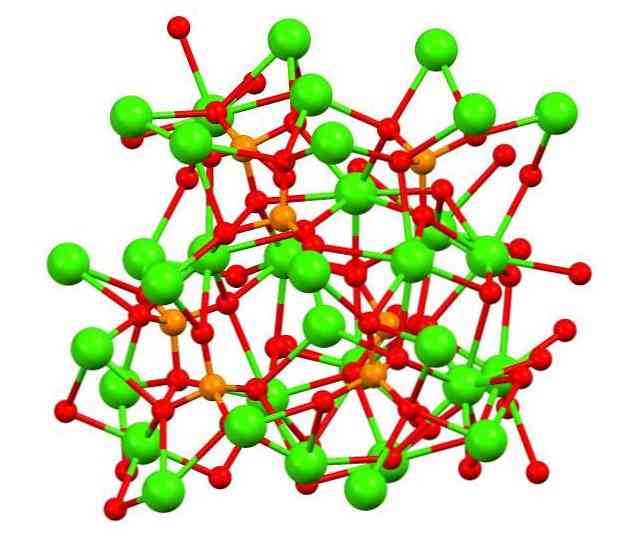
A felső képen látható a furcsa fehérjeszerű ásványi ásványi eredetű tribázikus calico-foszfát szerkezete, amely szennyező anyagként magnéziumot és vasat tartalmazhat..
Bár első pillantásra összetettnek tűnhet, tisztázni kell, hogy a modell kovalens kölcsönhatásokat feltételez a foszfátok oxigénatomjai és a kalcium fémközpontjai között..
Képviseletként érvényes, de az interakciók elektrosztatikusak; azaz kationok Ca2+ vonzza a PO anionokat43- (Ca2+- O-PO33-). Ezt szem előtt tartva megértjük, hogy a képen a kalcium (zöld gömbök) negatív töltésű oxigénatomokkal (piros gömbökkel) van körülvéve.
Ha annyi ion van, akkor nem marad szimmetrikus elrendezés vagy minta látható. A Ca3(PO4)2 Alacsony hőmérsékleten (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, annak rövidítése angolul).
Magas hőmérsékleten viszont a polimorf a-Ca-ba transzformálódik3(PO4)2 (a-TCP), amelynek egységcellája egy monoklinikus kristályos rendszernek felel meg. Még magasabb hőmérsékleteken is kialakulhat a polimorf a'-Ca3(PO4)2, amely hatszögletű kristályszerkezettel rendelkezik.
Amorf kalcium-foszfát
A sótól elvárható kalcium-foszfát kristályszerkezeteit említik. Ugyanakkor képes rendezetlen és aszimmetrikus struktúrák megjelenítésére, amelyek inkább a "kalcium-foszfát üveg" típusához kapcsolódnak, mint a kristályokhoz, a meghatározás szigorú értelemben..
Amikor ez megtörténik, azt mondják, hogy a kalcium-foszfát amorf szerkezetű (ACP, amorf kalcium-foszfát). Számos szerző ezt a fajta struktúrát a Ca biológiai tulajdonságaiért felelős3(PO4)2 csontszövetekben, javítása és biomimetizálása lehetséges.
A nukleáris mágneses rezonancia (NMR) szerkezetének tisztázásával az OH-ionok jelenlétét találtuk- és HPO42- az AKCS-országokban. Ezeket az ionokat az egyik foszfát hidrolízisével képezik:
PO43- + H2O <=> MSZH42- + OH-
Ennek eredményeképpen az AKCS valódi szerkezete összetettebbé válik, amelynek ionjainak összetételét a következő képlet képviseli: Ca9(PO4)6-X(MSZH4)x(OH)x. Az 'x' jelzi a hidratáció mértékét, mivel ha x = 1, akkor a képlet: Ca9(PO4)5(MSZH4) (OH).
A PCA különböző struktúrái a Ca / P mólarányoktól függhetnek; azaz a kalcium és a foszfát relatív mennyisége, amely az összes összetételüket megváltoztatja.
A család többi része
A kalcium-foszfátok valójában szervetlen vegyületek családja, amelyek kölcsönhatásba léphetnek egy szerves mátrixgal.
A többi foszfátot "egyszerűen" kapjuk a kalciumot kísérő anionok megváltoztatásával (PO43-, MSZH42-, H2PO4-, OH-), valamint a szilárd anyagban lévő szennyeződések típusát. Így akár tizenegy kalcium-foszfát vagy több, mindegyiknek saját szerkezete és tulajdonságai lehetnek természetes vagy mesterséges eredetűek..
Az alábbiakban néhány foszfát és megfelelő szerkezete és kémiai képletei vannak:
-Hidrogén-kalcium-foszfát-dihidrát, CaHPO4H 2H2O: monoklinikus.
-Kalcium-dihidrogén-foszfát-monohidrát, Ca (H)2PO4)2∙ H2O: triclinic.
-Vízmentes diacid-foszfát, Ca (H)2PO4)2: triclinic.
-Occalcium-hidrogén-foszfát (OCP), Ca8H2(PO4)6: triclinic Ez a hidroxiapatit szintézisének prekurzora.
-Hydroxyapatite, Ca5(PO4)3OH: hatszögletű.
Fizikai és kémiai tulajdonságok
nevek
-Kalcium-foszfát
-Trikalcium-foszfát
-Trikalcium-difoszfát
Molekulatömeg
310,74 g / mol.
Fizikai leírás
Szagtalan fehér szilárd anyag.
aroma
ízetlen.
Olvadáspont
1670 K (1391 ° C).
oldhatóság
-Vízben gyakorlatilag nem oldódik.
-Etanolban nem oldódik.
-Híg sósavban és salétromsavban oldódik.
sűrűség
3,14 g / cm33.
Törésmutató
1629
A képzés standard entalpiája
4126 kcal / mol.
Tárolási hőmérséklet
2-8 ° C.
pH
6-8 ° C-on 50 g / l kalcium-foszfát vizes szuszpenziójában.
edzés
Kalcium-nitrát és hidrogén-ammónium-foszfát
A kalcium-foszfát előállítására vagy formálására számos módszer létezik. Az egyik két só, a Ca (NO) keverékéből áll.3)2H 4H2O és (NH4)2MSZH4, korábban abszolút alkoholban és vízben oldva. Az egyik só kalciumot és a másik foszfátot biztosít.
Ebből a keverékből az AKCS-csapadék válik ki, amelyet ezután 800 ° C-on és 2 órán át melegítünk kemencében. Ennek az eljárásnak a eredményeként β-Ca-t kapunk3(PO4)2. A hőmérséklet, a keverés és az érintkezési idők gondos szabályozásával nanokristályos képződés léphet fel.
A polimorf a-Ca képződése3(PO4)2 a foszfátot 1000 ° C fölé kell melegíteni. Ezt a melegítést más fémionok jelenlétében hajtjuk végre, amelyek ezt a polimorfot megfelelően stabilizálják, hogy szobahőmérsékleten alkalmazzuk; azaz stabil meta állapotban marad.
Kalcium-hidroxid és foszforsav
A kalcium-foszfátot úgy állíthatjuk elő, hogy a kalcium-hidroxid és a foszforsav oldatát sav-bázis semlegesítéssel keverjük össze. Az anyalúgban lévő fél napos érlelés és megfelelő szűrés, mosás, szárítás és szitálás után az amorf foszfát granulált port kapunk..
Ez az AKCS-reakció magas hőmérsékleteket eredményez, átalakulva az alábbi kémiai egyenletek szerint:
2ca9(MSZH4) (PO4)5(OH) => 2Ca9(P2O7)0.5(PO4)5(OH) + H2O (T = 446,60 ° C)
2ca9(P2O7)0.5(PO4)5(OH) => 3Ca3(PO4)2 + 0,5 H2O (T = 748,56 ° C)
Ily módon a p-Ca-t kapjuk3(PO4)2, leggyakoribb és stabilabb polimorfja.
alkalmazások
A csontszövetben
A Ca3(PO4)2 A csonthamu fő szervetlen összetevője. Ez a csontpótló transzplantációk összetevője, ami magyarázható annak kémiai hasonlóságával a csontban lévő ásványokkal.
A kalcium-foszfát-biológiai anyagokat a csonthibák korrigálására és a titánfém protézisek bevonására használják. A kalcium-foszfátot elhelyezik rajtuk, izolálják őket a környezetből, és lassítják a titán korrózió folyamatát.
Kalcium-foszfátok, beleértve a Ca-t is3(PO4)2, Ezeket kerámiaanyagok előállítására használják. Ezek az anyagok biokompatibilisek, és jelenleg alkalmaznak az alveoláris csontvesztés helyreállítására, ami a parodontális betegségből, az endodontikus fertőzésekből és más körülményekből ered..
Ezeket azonban csak a periapikális csontjavítás felgyorsítására használják, olyan területeken, ahol nincs krónikus bakteriális fertőzés.
A kalcium-foszfát felhasználható a csonthibák javítására, ha nem lehetséges egy autogén csontgraft alkalmazása. Lehetséges, hogy önmagában vagy biológiailag lebontható és reszorbeálódó polimerrel, például poliglikolsavval együtt alkalmazzuk..
Biokerámiai cementek
A kalcium-foszfát cement (CPC) egy másik biokerámia, amelyet a csontszövet javítására használnak. A különböző típusú kalcium-foszfátok porának vízzel való összekeverésével készül, amely pasztát képez. A pasztát lehet befecskendezni vagy a csonthibához vagy üreghez igazítani.
A cementeket formázzák, fokozatosan reszorbeálják és az újonnan kialakított csontokkal helyettesítik.
orvosi
-A Ca3(PO4)2 Ez egy bázikus só, ezért antacidként alkalmazzák a felesleges gyomorsav semlegesítésére és a pH növelésére. A fogkrémben a kalcium és a foszfát forrását képezi a fogak és a csont hemosztázis remineralizációjának elősegítésére..
-Táplálékkiegészítőként is használják, bár a kalcium helyettesítésének legolcsóbb módja a karbonát és a citrát használata..
-A kalcium-foszfát a tetániás, a látens hipokalcémia és a fenntartó terápia kezelésére alkalmazható. Ezenkívül hasznos a kalcium pótlásában a terhesség és a szoptatás alatt.
-Ezt alkalmazzák a kezelésére való szennyeződés radioaktív izotópok sugara (Ra-226) és stroncium (Sr-90). Kalcium-foszfát gátolja a felszívódását a radioaktív izotópok az emésztőrendszerben, így korlátozva a általuk okozott károk.
mások
-A kalcium-foszfátot madarak takarmányaként használják. Ezenkívül fogkrémekben használják a fogkő szabályozására.
-Ragasztószerként használják, például az asztali só tömörödésének megakadályozására.
-A liszt fehérítőszerként működik. Eközben cochino vaj megakadályozza a nemkívánatos elszíneződés, és javítja a feltétele a sütéshez.
referenciák
- Tung M.S. (1998) Kalcium-foszfátok: szerkezet, összetétel, oldhatóság és stabilitás. In: Amjad Z. (szerk.) Kalcium-foszfátok biológiai és ipari rendszerekben. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu Chao Xu, Suchun Yu, Wu Xiaopei és Honglian Dai. (2018). "Synthesis, jellemzése Nano-β-trikalcium-foszfát és a hepatocellularis carcinoma a gátlása A sejteket", Journal of Nanoanyagok, vol. 2018, cikkszám: 7083416, 7 oldal, 2018.
- Combes, Krisztus és Rey, Christian. (2010). Amorf kalcium-foszfátok: szintetizálás, tulajdonságok és felhasználás biomateriumokban. Acta Biomaterialia, kötet. 6 (n ° 9). pp. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Trikalcium-foszfát. Lap forrása: en.wikipedia.org
- Abida és mtsai. (2017). Trikalcium-foszfátpor: Előkészítés, jellemzés és tömörítési képesség. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- Pubchem. (2019). Kalcium-foszfát. Lap forrása: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Kalcium-foszfát. Science Direct. Visszaváltva: sciencedirect.com


