Molekuláris geometria típusok és példák
az molekuláris geometria vagy molekuláris szerkezete az atomok térbeli eloszlása a központi atom körül. Az atomok olyan régiókat reprezentálnak, ahol magas az elektronikus sűrűség, és ezért elektronikus csoportoknak tekintik, függetlenül attól, hogy milyen linkek vannak (egyszeri, kettős vagy hármas).
Ez a koncepció két elmélet kombinációjából és kísérleti adataiból származik: a valenciakötés (TEV) és a valence shell (VSPR) elektronikus párjainak visszahúzódása. Míg az első meghatározza a kapcsolatokat és azok szögeit, a második meghatározza a geometriát és így a molekuláris szerkezetet.

Milyen geometriai alakzatok a molekulák, amelyek képesek befogadni? A két korábbi elmélet biztosítja a válaszokat. A VSEPR szerint a szabad elektronok atomjait és párjait úgy kell elrendezni, hogy az elektrosztatikus repulzió minimális legyen..
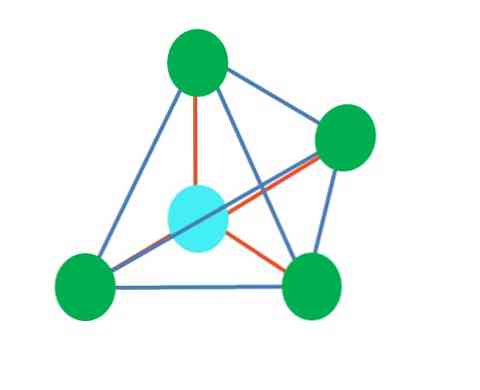
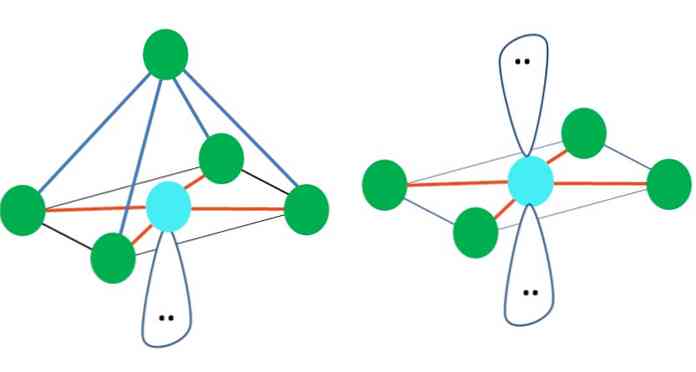
Tehát a geometriai alakzatok nem önkényesek, hanem a legstabilabbak. Például a felső képen egy háromszög látható balra, és egy oktaéder jobbra. A zöld pontok az atomokat és a narancssárga csíkokat jelölik.
A háromszögben a három zöld pont 120 ° -os szétválasztásban van. Ez a szög, amely megegyezik a kötéséval, lehetővé teszi, hogy az atomok a lehető legkisebb mértékben visszavonják egymást. Ezért a három másikhoz kapcsolódó központi atomhoz tartozó molekula trigonális sík geometriát alkalmaz.
A VSCR azonban azt jósolja, hogy a központi atomban lévő szabad elektronpárok torzítják a geometriát. A trigonális sík esetében ez a pár lenyomja a három zöld pontot, ami trigonális piramis geometriát eredményez.
Ugyanez történhet a kép oktaéderével is. Ebben minden atomot a lehető legstabilabb módon választjuk el egymástól.
index
- 1 Hogyan ismerjük előre az atom X molekuláris geometriáját?
- 2 típus
- 2.1 Lineáris
- 2.2 Szög
- 2.3
- 2.4 Trigonális bipiramid
- 2.5
- 2.6 Egyéb molekuláris geometriák
- 3 Példák
- 3.1 Lineáris geometria
- 3.2 Szöggeometria
- 3.3 Trigonális terv
- 3.4 Tetrahéder
- 3.5 Trigonális piramis
- 3.6 trigonal Bipyramid
- 3.7 Oszcilláló
- 3.8 A T alakja
- 3.9 Oktaedrális
- 4 Referenciák
Hogyan ismerjük előzetesen az X atom molekuláris geometriáját??
Ehhez meg kell vizsgálni a szabad elektronok párjait is elektronikus csoportként. Ezek az atomokkal együtt meghatározzák, hogy mi az elektronikus geometria, amely a molekuláris geometria elválaszthatatlan társa.
Az elektronikus geometriából, és miután a Lewis felismerte a szabad elektronok párjait, megállapíthatjuk, hogy mi lesz a molekuláris geometria. Az összes molekuláris geometria összege körvonalazza a globális struktúrát.
típus
Amint az a főképen látható, a molekuláris geometria attól függ, hogy hány atom van a központi atom körül. Azonban, ha egy elektronpár pár nélkül van jelen, akkor módosítja a geometriát, mert sok kötetet foglal el. Ezért szterikus hatást fejt ki.
Ennek megfelelően a geometria számos molekulára jellemző jellegű alakzatokat jeleníthet meg. És ez az, ahol különböző típusú molekuláris geometria vagy molekuláris szerkezet keletkezik.
Mikor egyenlő a geometria? Mindkettő csak akkor azonos, ha a szerkezetnek nincs több geometriája; ellenkező esetben figyelembe kell venni a jelenlegi típusokat és a struktúrát globális névvel kell ellátni (lineáris, elágazó, gömbölyű, lapos stb.).
A geometriák különösen hasznosak egy szilárd szerkezet szerkezetének magyarázatára a szerkezeti egységekből.
lineáris
Minden kovalens kötés irányított, így az A-B kapcsolat lineáris. De az AB molekula lineáris lesz?2? Ha igen, a geometria egyszerűen: B-A-B. A két B atom 180 ° -os szöggel van elválasztva, és a TEV szerint az A-nak sp hibrid orbitáinak kell lennie.
szögletes
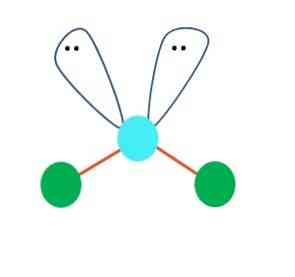
Elsőként feltételezhető, hogy az AB molekula lineáris geometriája2; Mindazonáltal elengedhetetlen, hogy a következtetések meghozatala előtt felhívjuk Lewis szerkezetét. Lewis szerkezetét rajzolva azonosíthatjuk az elektronok párjainak számát (:) az A atomjánál.
Ha ez így van, az elektronpárok tetején a két B atomot lefelé tolják, és megváltoztatják a szögüket. Ennek eredményeként a B-A-B lineáris molekula egy V, bumeráng vagy szöggeometriavá válik (felső kép)
A H-O-H vízmolekula ideális példája az ilyen típusú geometriának. Az oxigénatomban két pár elektron van megosztva, amelyek közelítőleg 109 ° -os szöget zárnak be.
Miért ez a szög? Mivel az elektronikus geometria tetraéderes, amely négy csúcsot tartalmaz: kettő a H atomokhoz és kettő az elektronokhoz. A fenti képen vegye figyelembe, hogy a zöld pontok és a két "lebeny szemével" tetraédert rajzol a kékes ponttal a középpontjában.
Ha O-nak nincs szabad elektronpárja, a víz lineáris molekulát képezne, polaritása csökken, és az óceánok, a tengerek, a tavak stb..
tetraéderes
A felső kép a tetraéderes geometriát mutatja. A vízmolekula esetében az elektronikus geometriája tetraéderes, de az elektronmentes párok kiküszöbölésével észrevehető, hogy szöggeometriává alakul át. Ezt egyszerűen csak két zöld pont eltávolításával figyelték meg; a fennmaradó kettő a V pontot a kék ponttal rajzolja meg.
Mi van, ha két szabad elektronikon helyett csak egy volt? Akkor lenne egy trigonális sík (főkép). Azonban egy elektronikus csoport kiküszöbölésével nem szabad elkerülni a szabad elektronok párja által előállított sztérikus hatást. Ezért torzítja a trigonális síkot egy háromszög alakú piramisra:

Bár a trigonális és a tetraéderes piramis molekuláris geometria eltérő, az elektronikus geometria ugyanaz: tetraéder. Tehát a trigonális piramis nem számít elektronikus geometriának?
A válasz nem, mivel ez a "szemek lebenye" által okozott torzítás és a sztérikus hatás eredménye, és ez a geometria nem veszi figyelembe a későbbi torzulásokat.
Ezért mindig fontos, hogy a molekuláris geometria meghatározása előtt először meghatározzuk az elektronikus geometriát Lewis struktúrák segítségével. Az ammónia molekula, NH3, példa a trigonális piramis molekuláris geometriájára, de tetraéderes elektronikus geometriával.
Trigonal Bipyramid
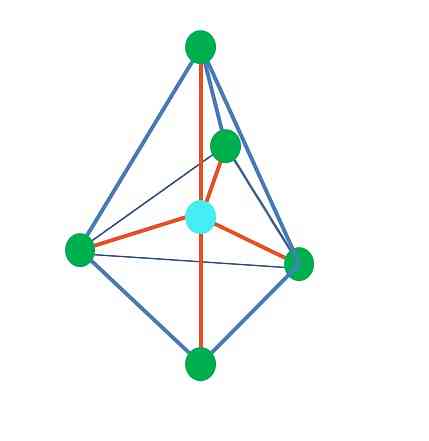
Eddig, a lineáris geometria kivételével, a tetraéderben a szögletes és a trigonális piramisa központi atomjainak hibridizációja van.3, a TEV szerint. Ez azt jelenti, hogy ha a kapcsolatszögeit kísérleti úton határozták meg, akkor 109 ° körül kell lenniük.
A trigonális dipiramid geometriából öt központi csoport található a központi atom körül. A felső képen látható az öt zöld pont; három a háromszögben, és kettő axiális helyzetben, amelyek a piramis felső és alsó csúcsai.
Milyen hibridizációval rendelkezik a kék pont? Öt hibrid pályára van szüksége az egyszerű kötések (narancs) létrehozásához. Ez az öt sp orbitán keresztül érhető el3d (az orbitális s, három p és a d keverék terméke).
Öt elektronikus csoportot tekintve a geometria a már kitett, de az elektronok párja megosztása nélkül, ez ismét torzításokat okoz, amelyek más geometriákat generálnak. A következő kérdés is felmerül: lehet-e ezek a párok elhelyezni a piramis helyét? Ezek a következők: axiális vagy egyenlítői.
Axiális és egyenlítői pozíciók
A háromszög alapját képező zöld pontok egyenlítői helyzetben vannak, míg a kettő a felső és az alsó végén axiális helyzetben van. Hol lehet elhelyezni az elektronok párát megosztása nélkül? Ebben a helyzetben, amely minimálisra csökkenti az elektrosztatikus repulziót és sztérikus hatást.
Axiális helyzetben az elektronpár párhuzamosan (90 °) nyomja meg a háromszög alapját, míg ha egyenlítői helyzetben lenne, a bázis két fennmaradó elektronikus csoportja 120 ° -ra szétválasztható lenne, és mindkét végét 90 ° -kal nyomja meg (ahelyett, hogy a szögletet el nem érte). három, mint az alap).
Ezért a központi atom arra törekszik, hogy az elektronmentes pártjait az egyenlítői pozíciókban stabilabb molekuláris geometriákhoz hozza létre.
Oszcilláló és T alakú
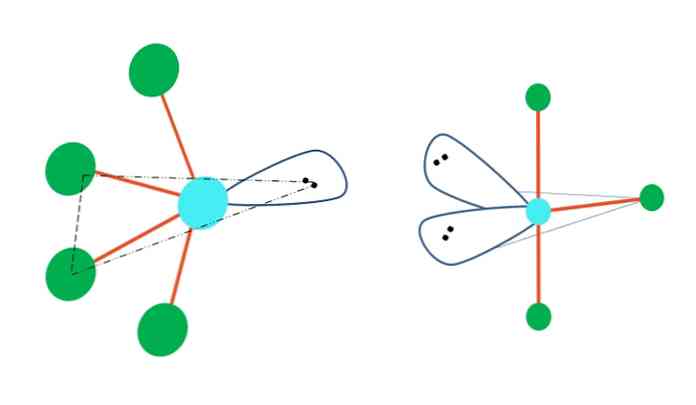
Ha a trigonális bipiramid geometria egy vagy több atomját elektron-mentes párokkal helyettesíti, akkor más molekuláris geometriájuk is lenne.
A felső kép bal oldalán a geometria az oszcilláló alakra változik. Ebben az esetben a szabad elektronpárok a négy atomot ugyanabba az irányba tolják el, és a bal oldali linkeket összecsukják. Megjegyezzük, hogy ez a pár és két atom az eredeti dipiramid azonos háromszögbeli síkjában helyezkedik el.
A képtől jobbra a T-alakú geometria: ez a molekuláris geometria abból áll, hogy két atomot két elektron-pár helyettesít, ami azt eredményezi, hogy a fennmaradó három atom ugyanabban a síkban van, hogy pontosan egy levelet rajzoljon T.
Tehát egy AB típusú molekulához5, elfogadja a trigonális bipiramid geometriát. Azonban AB4, ugyanazzal az elektronikus geometriával, az oszcilláló geometriát alkalmazza; és AB3, A T-alakú geometria mindegyikében A (általában) sp hibridizációval rendelkezik3d.
A molekuláris geometria meghatározásához szükség van a Lewis-struktúra és ezért az elektronikus geometriájának megrajzolására. Ha ez egy trigonális bipiramid, akkor az elektronmentes párokat eldobjuk, de nem a sztatikus hatásukat a többi atomra. Így a három lehetséges molekuláris geometria között tökéletesen megkülönböztethető.
nyolcoldalú
Az oktaéderes molekuláris geometria a fő kép jobb oldalán látható. Az ilyen típusú geometria megfelel az AB vegyületeknek6. AB4 a négyzet alapját képezik, míg a fennmaradó két B tengelyirányban van elhelyezve. Így több egyenlő oldalú háromszög alakul ki, amelyek az oktaéder arcai.
Itt is lehet (mint minden elektronikus geometriában) szabad elektronpárok, és ezért más molekuláris geometriák is ebből a tényből származnak. Például AB5 az oktaéderes elektronikus geometriával négyszögletű piramis és AB4 négyzet alakú sík:
Az oktaéderes elektronikus geometria esetében ezek a két molekuláris geometria az elektrosztatikus elnyomás szempontjából a legstabilabbak. Négyszögletes sík geometriában a két elektronpár párosul 180 °.
Mi a hibridizáció az A atom számára ezekben a geometriákban (vagy struktúrákban, ha ez az egyetlen)? Ismét a TEV megállapítja, hogy sp3d2, hat hibrid pálya, amely lehetővé teszi az A számára, hogy az oktaéder csúcsain irányítsa az elektronikus csoportokat.
Egyéb molekuláris geometriák
Az eddig említett piramisok alapjainak módosításával néhány összetettebb molekuláris geometria érhető el. Például az ötszögletű bipiramid egy ötszögre és az azt alkotó vegyületekre épül, amelyek általános képlettel rendelkeznek.7.
A többi molekuláris geometriához hasonlóan, az elektronmentes párok B atomjainak helyettesítése torzítja a geometriát más formákra..
Emellett az AB vegyületek8 olyan geometriákat fogadhatnak el, mint a négyszögletes antiprism. Egyes geometriák nagyon bonyolultak lehetnek, különösen az AB képleteknél7 tovább (AB-ig12).
Példák
Ezután egy sor vegyületet említünk mindegyik fő molekuláris geometriára vonatkozóan. Gyakorlatként a Lewis-struktúrákat az összes példához rajzolhatod, és igazolhatod, hogy az elektronikus geometriát figyelembe véve az alábbi molekuláris geometriákat kapod..
Lineáris geometria
-Etilén, H2CII2
-Beril-klorid, BeCl2 (Cl-Be-Cl)
-Szén-dioxid, CO2 (O = C = O)
-Nitrogén, N2 (N≡N)
-Higany dibromid, HgBr2 (Br-Hg-Br)
-Anion trijodid, I3- (I-I-I)
-Hidrogén-cianid, HCN (H-N≡C)
Szögének 180º-nak kell lennie, és ezért sp-hibridizációjuk van.
Szög geometria
-A víz
-Kén-dioxid, SO2
-Nitrogén-dioxid, NO2
-Ózon, O3
-Anion amiduro, NH2-
Trigonális sík
-Bróm-trifluorid, BF3
-Alumínium-triklorid, AlCl3
-Nitrát anion, NO3-
-Anion-karbonát, CO32-
tetraéderes
-Metángáz, CH4
-Szén-tetraklorid, CCl4
-Kation-ammónium, NH4+
-Anion-szulfát, SO42-
Trigonális piramis
-Ammónia, NH3
-Kation-hidronium, H3O+
Trigonal Bipyramid
-Foszfor-pentafluorid, PF5
-Antimon Pentaklorid, SbF5
oszcilláló
Kén-tetrafluorid, SF4
T alakja
-Jód-triklorid, ICl3
-Klorid-trifluorid, ClF3 (mindkét vegyület interhalogénként ismert)
nyolcoldalú
-Kén-hexafluorid, SF6
-Szelén-hexafluorid, SeF6
-Hexafluor-foszfát, PF6-
A molekuláris geometria az anyag kémiai vagy fizikai tulajdonságainak megfigyelését magyarázza. Azonban az elektronikus geometria szerint van kialakítva, így az utóbbit mindig az első előtt kell meghatározni.
referenciák
- Whitten, Davis, Peck és Stanley. Kémia. (8. kiadás). CENGAGE Learning, 194-198.
- Shiver & Atkins. (2008). Szervetlen kémia (Negyedik kiadás., 23., 24., 80., 169. o.). Mc Graw-hegy.
- Mark E. Tuckerman. (2011). Molekuláris geometria és a VSEPR elmélet. Lap forrása: nyu.edu
- Virtuális Chembook, Charles E. Ophardt. (2003). Bevezetés a molekuláris geometriába. Lap forrása: chemistry.elmhurst.edu
- Kémia LibreTexts. (2016. szeptember 8.). A molekulák geometriája. Lap forrása: chem.libretexts.org


