Berillium-hidrid (BeH2) kémiai szerkezete, tulajdonságai és felhasználása
az berillium-hidrid az alkáliföldfém-berillium és a hidrogén közötti kovalens vegyület. Kémiai képlete a BeH2, és kovalens, nem áll a Be ionból2+ és H-. A LiH-val együtt az egyik legkönnyebb szintetizálható fém-hidrid.
Dimetilberil, Be (CH3)2, lítium-alumínium-hidrid, LiAlH4. Azonban a BeH2 A legtisztább di-terc-butilberillium, Be (C (CH3)3)2 210 ° C-on.

Mint egy egyedi molekula gáznemű állapotban, geometriában lineáris, de szilárd és folyékony állapotban háromdimenziós hálózatok tömbjeiben polimerizálódik. Ez egy amorf szilárd anyag normál körülmények között, és kristályossá válhat, és hatalmas nyomáson fémes tulajdonságokat mutathat.
Ez a hidrogén tárolási módját képviseli, akár bomláskor hidrogénforrásként, akár szilárd abszorbens gázként. Azonban a BeH2 Nagyon mérgező és szennyező, mivel a berillium nagyon polarizáló jellegű.
index
- 1 Kémiai szerkezet
- 1.1 A BeH2 molekula
- 1.2 BeH2 láncai
- 1.3 A BeH2 háromdimenziós hálózatai
- 2 Tulajdonságok
- 2.1 Kovalens karakter
- 2.2 Kémiai képlet
- 2.3 Fizikai megjelenés
- 2.4 Oldhatóság vízben
- 2.5 Oldhatóság
- 2.6 Sűrűség
- 2.7 Reaktivitás
- 3 Használat
- 4 Referenciák
Kémiai szerkezet
BeH molekula2
Az első képen egy gázhalmazállapotú berillium-hidrid egyedi molekulája látható. Megjegyezzük, hogy geometriája lineáris, a H-atomok 180 ° -os szöget zárnak el egymástól. Az ilyen geometria magyarázatához a Be atomnak sp-hibridizációval kell rendelkeznie.
A berilliumnak két valens elektronja van, amelyek a 2s-es pályán találhatók. A valencia kötéselmélet szerint a 2s orbitális egyik elektronja energikusan mozdul el a 2p orbitálisnak; és ennek következtében két kovalens kötést képezhet a két sp hibrid orbitonnal.
És mi a helyzet a Be szabad többi kerületével? Két másik tiszta 2p pálya áll rendelkezésre, nem hibridizálva. Azokkal üres, a BeH2 ez az elektronok hiányos gáznemű vegyület; és ezért molekuláik hűtésével és csoportosításával polimerben kondenzálódnak és kristályosodnak.
BeH láncok2
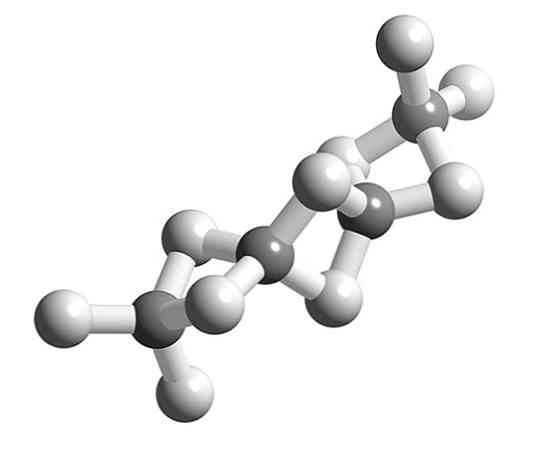
Ha BeH molekulák2 polimerizálódik, a Be atom környező geometriája megszűnik lineáris és tetraéderes lesz.
Korábban ennek a polimernek a szerkezetét úgy modelleztük, mintha a BeH-egységekkel láncok lennének2 hidrogénhidakkal összekötve (felső kép, fehér és szürke tónusú gömbökkel). Ellentétben a dipol-dipol kölcsönhatások hidrogénkötéseivel, kovalens karakterük van.
A polimer Be-H-Be hídjában két elektron van elosztva a három atom között.link 3c, 2e), amely elméletileg nagyobb valószínűséggel a hidrogénatom körül kell elhelyezkednie (mert több elektronegatív).
Másrészt a négy H körülvett Be sikerül viszonylag kitölteni az elektronikus üresedését, kiegészítve a valencia-oktettjét.
Itt a valencia kötéselmélet viszonylag pontos magyarázatot ad. Miért? Mivel a hidrogénnek csak két elektronja van, és a -H- kapcsolat négy elektron részvételével jár.
Tehát a Be-H hidak magyarázata2-A Be (két szürke gömb, melyet két fehér gömb köt össze) a kötés más összetett modelljeire van szükség, mint amilyeneket a molekuláris orbitális elmélet biztosít..
Kísérletileg kimutatták, hogy a BeH polimer szerkezete2 Ez nem egy lánc, hanem egy háromdimenziós hálózat.
A BeH háromdimenziós hálózatai2
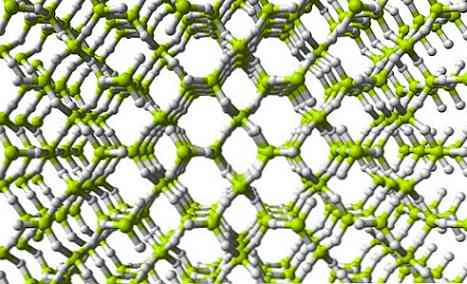
A felső képen a háromdimenziós BeH hálózat egy része látható2. Ne feledje, hogy a sárgás zöld gömbök, a Be atomjai egy tetraédert alkotnak, mint a láncban; ebben a szerkezetben azonban nagyobb a hidrogénhidak száma, emellett a szerkezeti egység már nem a BeH2 de a BeH4.
Ugyanazok a BeH szerkezeti egységek2 és BeH4 azt jelzik, hogy a hálózatban nagyobb a hidrogénatomok száma (4 H atom minden egyes Be).
Ez azt jelenti, hogy a berillium ezen a hálózaton belül még többet képes betölteni, mint egy láncszerű polimer szerkezet..
És ez a polimer legnyilvánvalóbb különbsége a BeH egyedi molekulájához képest2, az, hogy a Be-nak szükségszerűen sp-hibridizációval kell rendelkeznie3 (Általában) a tetraéderes és nemlineáris geometriák magyarázatára.
tulajdonságok
Kovalens karakter
Miért van a berillium-hidrid kovalens és nemionos vegyület? A 2. csoport többi elemének (Becamgbara) hidridjei ionosak, azaz egy kation által képzett szilárd anyagból állnak.2+ és két hidrid anion- (MGH2, CaH2, BAH2). Ezért a BeH2 Nem a Be2+ és H- elektrosztatikusan kölcsönhatásba lép.
A kation Be2+ Magas polarizációs ereje jellemzi, ami torzítja a környező atomok elektronikus felhőit.
E torzítás eredményeként a H anionok- kovalens kötéseket alkotnak; kapcsolatok, amelyek az éppen ismertetett struktúrák sarokköve.
Kémiai képlet
Beh2 vagy (BeH2) n
Fizikai megjelenés
Színtelen amorf szilárd anyag.
Oldhatóság vízben
Lebomlik.
oldhatóság
Dietil-éterben és toluolban nem oldódik.
sűrűség
0,65 g / cm3 (1,85 g / l). Az első érték a gázfázisra, a második pedig a polimer szilárd anyagra vonatkozik.
reakcióképesség
Reagál lassan vízzel, de a HCl gyorsan hidrolizálódik, hogy berillium-kloridot, BeCl-t képezzen2.
A berillium-hidrid Lewis-bázisokkal, különösen a trimetil-aminnal, N-vel (CH) reagál.3)3, egy dimer adduktumot képeznek hídhidridekkel.
Emellett reagálhat a dimetil-aminnal, hogy trimer berylium-diamidot képezzen, [Be (N (CH3)2)2]3 és hidrogén. A reakció lítium-hidriddel, ahol a H ion- Lewis alapja, LIBeH3 és Li2Beh4.
alkalmazások
A berillium-hidrid ígéretes módja lehet a molekuláris hidrogén tárolásának. A polimer lebontásával H szabadul fel2, amely rakéta-üzemanyagként szolgálna. Ebből a megközelítésből a háromdimenziós hálózat több hidrogént tárolna, mint a láncok.
Továbbá, ahogy a hálózat képe is látható, vannak pórusok, amelyek lehetővé teszik a H molekulák befogadását.2.
Valójában egyes tanulmányok szimulálják a fizikai tárolást a BeH-ban2 kristályos; azaz a hatalmas nyomásnak kitett polimer, és milyen fizikai tulajdonságai vannak különböző mennyiségű hidrogént adszorbeálva.
referenciák
- Wikipedia. (2017). Berillium-hidrid. Lap forrása: en.wikipedia.org
- Armstrong, D. R., Jamieson, J. & Perkins, P.G. Elméleti. Chim. Acta (1979) A polimer biklór-hidrid és polimer bórhidrid elektronikus szerkezetei. 51: 163. doi.org/10.1007/BF00554099
- 3. fejezet: Berillium-hidrid és oligomerjei. Lap forrása: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger és U. P. Verma. (2014). A BeH szerkezeti és elektronikus viselkedésének vizsgálata2 mint hidrogén tároló vegyület: egy Ab Initio megközelítés. Conference Papers in Science, Vol. 2014, 807893. Cikk, 5 oldal. doi.org/10.1155/2014/807893
- Shiver & Atkins. (2008). Szervetlen kémia Az 1. csoport elemei (negyedik kiadás). Mc Graw-hegy.


