Kalcium-hidrid (CaH2) tulajdonságai, reaktivitás és felhasználás
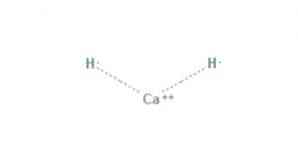
az kalcium-hidrid a (CaH2) általános képletű vegyi vegyület, amely alkáliföldfém-hidriddé teszi. Ez a kémiai vegyület két ionos kötéssel rendelkezik a kalcium és a két hidridion között, amint az az 1. ábrán látható.
Ez egy sós hidrid, ami azt jelenti, hogy szerkezete hasonló a sóhoz. Kristályos szerkezete megegyezik a 2. ábrán látható ólom-klorid (Cotunnite ásványi anyag) szerkezetével.

Valamennyi alkáli és alkáliföldfém hidrid sót képez. A kémia szempontjából a hidrid a hidrogén-anion, a H- vagy a leggyakrabban olyan vegyület, amelyben egy vagy több hidrogén-centrum nukleofil, redukáló vagy alapvető tulajdonságokkal rendelkezik..
A hidrideknek tekintett vegyületekben a hidrogénatom több elektropozitív elemhez vagy csoporthoz kapcsolódik.
A kalcium és a hidrogén 300 és 400 ° C közötti hőmérsékleten történő reagáltatásával állítható elő. A kalcium-hidrid előállításának egy másik módja, hogy a kalcium-kloridot hidrogénnel és nátrium-fémnel együtt melegítjük. A reakció a következőképpen történik:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Ebben a reakcióban a kalcium (Ca) és a hidrogén (H) kalcium-hidrid molekulát hoz létre, míg a nátrium-atomok a klórral együtt nátrium-klorid (NaCl) molekulákat hoznak létre..
A kalcium-hidridet úgy is előállíthatjuk, hogy a kalcium-oxidot (CaO) magnéziummal (Mg) redukáljuk. A reakciót hidrogén jelenlétében hajtjuk végre. Ez a reakció magnézium-oxidot (MgO) is termel. Az alábbiakban a kémiai reakció képlete látható:
CaO + Mg + H2 → CaH2 + MgO
index
- 1 A kalcium-hidrid fizikai és kémiai tulajdonságai
- 2 Reaktivitás és veszélyek
- 3 Kezelés és tárolás
- 4 Felhasználások és alkalmazások
- 4.1 Szárítószer
- 4.2 Hidrogéntermelés
- 4.3 Redukálószer
- 5 Hátrány a kalcium-hidrid használatában
- 6 Referenciák
A kalcium-hidrid fizikai és kémiai tulajdonságai
A kalcium-hidrid fehér kristályok halmaza, amely tiszta, fehér. Általában ritkán találják meg ezt a formát, így általában szürkés árnyalattal rendelkezik. Nincs jellegzetes szaga. Megjelenése a 3. ábrán látható (Royal Society of Chemistry, 2015).

Molekulatömege 42,094 g / mol, olvadáspontja 816 ° C és sűrűsége 1,70 g / ml. Ha vízben oldódik, hevesen reagál hidrogénnel. Ez is reagál az alkohollal (Nemzeti Biotechnológiai Információs Központ., S.F.).
Reaktivitás és veszélyek
A kalcium-hidrid stabil vegyi anyag, bár erősen reakcióképes a vízzel vagy a nedvességgel. Vízzel érintkezve gyúlékony hidrogéngázokat szabadít fel, amelyek spontán gyulladhatnak.
Robbanásveszélyes vegyületnek tekintik. Ha tetrahidrofuránnal reagáltatjuk, robbanást okozhat. Klorát, hipoklorit, bromát, kálium-perklorát keverékével érzékeny a hőre, súrlódásra és robbanásveszélyesvé válik (Calcium Hydride 7789-78-8, 2016).
Amikor az ezüst-fluoridot kalcium-hidriddel összetörik, a tömeg izzólámpává válik. A hidrid erős klórral, brómmal vagy jóddal történő melegítése izzadáshoz vezet.
A hidrid és különböző bromátok, például bárium-bromát vagy klorátok, például a bárium-klorid és a perklorátok, például a kálium-perklorát keverékei trituráláskor felrobbannak. Ha a súrlódásnak van kitéve, a CaH2 izzó fluoriddal reagál.
Ezt a vegyületet inert atmoszférában kell kezelni. Ha nem kezelik megfelelően, komoly veszélyt jelenthet a laboratóriumi személyzet, az életmentők és a vegyi hulladékkezelők egészségére és biztonságára (UC laboratóriumi biztonsági központ, 2013).
Rendkívül veszélyes bőrrel vagy szemmel való érintkezés esetén, mivel irritáló. Nagyon veszélyes a bőrrel való érintkezés esetén, mert maró hatású lehet.
Lenyelés és belégzés esetén is veszélyes. A szövetkárosodás mértéke a kontaktus hosszától függ. A szemmel való érintkezés szaruhártya-károsodást vagy vakságot okozhat.
A bőrrel való érintkezés gyulladást és hólyagokat okozhat. A por belélegzése irritálja a gasztrointesztinális vagy a légzőrendszert, amelyet az égés, tüsszentés és köhögés jellemez..
A súlyos túlzott expozíció tüdőkárosodást, fulladást, eszméletvesztést és akár halált okozhat. A szem gyulladását vörösség, irritáció és viszketés jellemzi. A bőrgyulladást viszketés, hámlás, bőrpír vagy esetenként hólyagosodás jellemzi.
A szemek alacsony szintre való ismételt expozíciója szemirritációt okozhat. A bőrrel való ismételt expozíció helyi bőrkárosodást vagy bőrgyulladást okozhat.
A por ismételt belélegzése változó fokú légúti irritációt vagy tüdőkárosodást okozhat. A por ismételt vagy tartós belégzése krónikus légúti irritációt okozhat (Anyagbiztonsági adatlap, kalcium-hidrid MSDS, 2005).
Szembe kerülés esetén azonnal bő vízzel kell öblíteni legalább 15 percig, esetenként felemelve a felső és alsó szemhéjakat..
Bőrrel való érintkezés esetén azonnal le kell öblíteni bő vízzel legalább 15 percig, miközben eltávolítja a szennyezett ruhát és cipőt.
Lenyelés esetén a hányást nem szabad kiváltani. Meg kell hívni a mérgezési központot. Javasoljuk, hogy hagyja el a kiállítási helyet, és azonnal lépjen a szabadban.
Belélegzés esetén, ha a légzés nehéz, oxigént kell biztosítani. A szájszáj-légzés nem adható, ha az áldozat lenyelte vagy belélegezte az anyagot.
A mesterséges lélegeztetés egy egyirányú szeleppel vagy más megfelelő légzőkészülékkel ellátott zseb maszk segítségével indukálható. Minden esetben azonnal orvoshoz kell fordulni.
Kezelés és tárolás
A vegyületet száraz tartályban kell tartani a hőtől távol. A gyújtóforrástól távol kell tartani. Ne lélegezze be a port. Ehhez a termékhez nem szabad vizet adni
Elégtelen szellőzés esetén megfelelő légzőkészüléket, például szűrőmaszkot kell viselni. Expozíció esetén orvoshoz kell fordulni és a címkét a lehető legnagyobb mértékben bemutatni. Kerülje a bőrrel és szemmel való érintkezést.
A gyúlékony anyagokat általában külön biztonsági szekrényben vagy tárolóhelyiségben kell tárolni. Tartsa szorosan zárva a tartályt.
Hűvös és jól szellőző helyen kell tartani. Az elektromos szikrák elkerülésére minden anyagot tartalmazó berendezést földelni kell. A tartályt szárazon és hűvös helyen kell tartani.
Nem gyúlékony anyag. A tűzoltóknak azonban megfelelő felszerelést kell viselniük, miközben a tüzet a kémiai vegyület körül eloltják.
Soha nem ajánlatos víz használata a tűz kalciumhidrid körüli eloltásához. Erre a célra száraz homokot, valamint olyan vegyületeket használhatunk, mint a nátrium-klorid és a nátrium-karbonát.
A kalcium-hidridhulladék eltávolításához az oldatot 25 ml metanol hozzáadásával nitrogén atmoszférában keverés közben bomlik le..
Miután a reakció befejeződött, a vizes kalcium-metoxidvegyülethez azonos térfogatú vizet adunk, és bő vízzel bocsátjuk ki a csatornába (National Research Council, 1995)..
Felhasználások és alkalmazások
Szárítószer
A kálium-hidrid viszonylag enyhe szárítószer. Ezen okból kifolyólag ennek a vegyületnek a szárítószerként való alkalmazása biztonságosabb, mint a reaktívabb szerek, mint például a nátrium-kálium és a nátrium-fémötvözetek. Reagál vízzel a következő módon:
CaH2 + 2 H20 → Ca (OH) 2 + 2 H2
Ennek a reakciónak a hidrolízis termékei, a hidrogén (gáz) és a Ca (OH) 2 (vizes elegy) elválaszthatók a kémiai oldószertől szűrés, desztillálás vagy dekantálás után..
Ez a kémiai vegyület hatásos szárítószer számos bázikus oldószerhez, például aminokhoz és piridinhez. Néha az oldószerek előszárítására használják, mielőtt reaktívabb szárítószereket használnának.
Hidrogéntermelés
Az 1940-es években ez a vegyület hidrogénforrásként „Hydrolith” márkanév alatt kapható..
Hosszú ideig hidrogénforrásként használták. Még mindig tiszta hidrogén előállítására használják különböző kísérletekhez, fejlett üzemanyagcellákhoz és akkumulátor-alkalmazásokhoz (American Elements, S.F.)..
A vegyületet évtizedek óta széles körben használják, mint az időjárási léggömbök felfújásának biztonságos és kényelmes eszköze.
Hasonlóképpen, a laboratóriumokban rendszeresen használják kis mennyiségű, nagy tisztaságú hidrogén előállítására kísérletekhez. A dízel üzemanyag nedvességtartalmát a CaH2-kezelés után kialakult hidrogén számítja ki.
Redukálószer
600 és 1000 Celsius fok közötti hőmérséklettartományban a cirkónium-oxid, a niobium, az urán, a króm, a titán, a vanádium és a tantál csökkenthető a fémek por előállítása érdekében, így a kalcium-hidrid használható a kohászatban. por.
A következő reakció bemutatja, hogy a kalcium-hidrid redukálószerként működik:
TiO + 2CaH2 → CaO + H2 + Ti
A kalcium-hidrid használatának hátránya
Ez a kémiai vegyület gyakran a szárítószerként előnyös választás; Ugyanakkor van néhány hátránya is:
-A vegyület szárítási hatása lassú, mivel nem oldódik semmilyen oldószerben, amellyel nem reagál hevesen.
-Ez a por vegyület nem kompatibilis számos oldószerrel. A klór-szénhidrogének reakciója akár robbanást is okozhat.
-Nem használható oldószerek oxigénmentesítésére, mivel nem képes feloldani az oldott oxigént.
-A kalcium-hidrid és a kalcium-hidroxid közötti megkülönböztetés hasonló megjelenése miatt meglehetősen nehéz.
referenciák
- Amerikai elemek. (S. F.). kalcium-hidrid. Az americanelements.com-tól származik: americanelements.com.
- 7789-78-8. Kalcium-hidrid. (2016). Visszanyerve a Chemicalbook.com-ról: chemicalbook.com.
- kalcium-hidrid. (N.d.). A kémia tanulója: chemistrylearner.com.
- Anyagbiztonsági adatlap Kalciumhidrid MSDS. (2005, október 10.). A (z) sciencelab.com webhelyről: sciencelab.com.
- Nemzeti Biotechnológiai Információs Központ. (S. F.). PubChem összetett adatbázis; CID = 105052. A (z) pubchem.ncbi.nlm.nih.gov címen található: pubchem.ncbi.nlm.nih.gov.
- nemzeti kutatási tanács. (1995). Prudens gyakorlatok a laboratóriumban: vegyi anyagok kezelése és ártalmatlanítása. Washinton: NationalAcademy Press.
- Királyi Kémiai Társaság. (2015). 94784. kalcium-hidrid azonosító. A chemspider.com webhelyről: chemspider.com.
- UC központ a laboratóriumi biztonság érdekében. (2013. január 18.). standard működési eljárás kalcium-hidrid. A kemengr.ucsb.edu: chemengr.ucsb.edu fájlból származik.


