Atom sugár, hogyan mérik, hogyan változik a periodikus táblázatban, példák
az atomsugár ez fontos paraméter a periodikus táblázat elemeinek időszakos tulajdonságaihoz. Ez közvetlenül kapcsolódik az atomok méretéhez, mivel nagyobb sugarú, nagyobb vagy nagyobb méretű. Hasonlóképpen, az elektronikus elektronikus jellemzőkhez kapcsolódik.
Amíg egy atomnak több elektronja van, annál nagyobb a mérete és az atom sugara. Mindkettőt a valencia héj elektronjai határozzák meg, mert a pályájukon túli távolságokon az elektronok valószínűsége nulla. Az ellenkezője a mag közelében van: az elektronok megtalálásának valószínűsége nő.

A felső kép egy pamut golyó csomagolását jelenti. Ne feledje, hogy mindegyiket hat szomszéd veszi körül, anélkül, hogy egy másik lehetséges felső vagy alsó sort számolna. A pamut golyók tömörítésének módja meghatározza azok méretét és így azok sugarait; ugyanúgy, mint az atomokkal.
Kémiai természetüknek megfelelő elemek egymással vagy egymással kölcsönhatásba lépnek saját atomjaikkal. Ezért az atomsugár nagysága a jelen lévő kötés típusától és atomjainak szilárd csomagolásától függően változik.
index
- 1 Hogyan mérhető az atom sugár?
- 1.1 A nukleáris távolság meghatározása
- 1,2 egység
- 2 Hogyan változik az időszakos táblázatban?
- 2.1 Egy időszak alatt
- 2.2 Csökken a csoport
- 2.3 Lantanid összehúzódás
- 3 Példák
- 4 Referenciák
Hogyan mérhető az atom sugár?
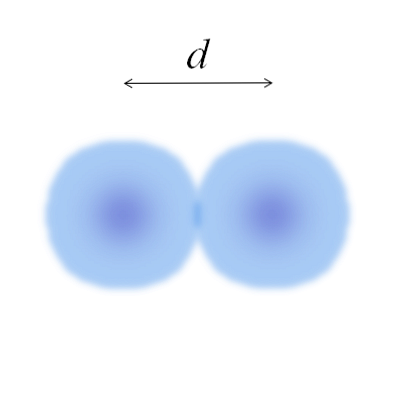
A főképen könnyen meg lehet mérni a pamut golyók átmérőjét, majd két részre osztjuk. Egy atom gömbje azonban nem teljesen meghatározott. Miért? Mivel az elektronok a tér bizonyos területein keringenek és diffundálnak: orbiták.
Ezért az atomot tarthatatlan élekkel rendelkező gömbnek tekinthetjük, amely lehetetlen azt mondani, hogy mennyire ér véget. Például, a felső képen a középső régió, a mag közelében, intenzívebbnek tűnik, míg a szélei homályosak.
A kép egy diatóma molekulát jelent2 (mint a Cl2, H2, O2, stb.) Feltételezve, hogy az atomok gömb alakú testek, ha a távolságot meghatároztuk d amely mindkét magot elválasztja a kovalens kötésben, akkor elég lenne két részre osztani (d/ 2) az atom sugár eléréséhez; pontosabban az E kovalens sugara az E számára2.
És ha E nem alkot kovalens kötéseket önmagával, hanem egy fém elem? majd d azt jelzi, hogy az E-t körülvevő szomszédok fémszerkezetükben vannak; azaz az atomnak a csomagoláson belüli koordinációs számával (N.C) (emlékezzen a fő kép pamut golyóira).
A nukleáris távolság meghatározása
Meghatározni d, amely a molekula vagy a csomagolás két atomjának nukleáris távolsága, fizikai elemzési technikákat igényel.
Az egyik leggyakrabban alkalmazott röntgendiffrakció, melyben egy fénysugarat sugárzunk át egy kristályon keresztül, és tanulmányozzuk az elektronok és az elektromágneses sugárzás közötti kölcsönhatásokból származó diffrakciós mintát. A csomagolástól függően különböző diffrakciós minták érhetők el, és így más értékek is lehetnek d.
Ha az atomok "feszesek" a kristályrácsban, akkor különböző értékeket mutatnak be d összehasonlítva azzal, amit „kényelmes” lenne. Ezek az átmeneti távolságok is oszcillálhatnak az értékekben, így az atom sugár ténylegesen az ilyen mérések átlagos értékéből áll..
Hogyan kapcsolódik az atomi sugár és a koordinációs szám? V. Goldschmidt kapcsolatot teremtett a kettő között, amelyben a 12-es N.C-re a relatív érték 1; 0,97-től egy olyan csomagoláshoz, ahol az atom N.C értéke 8; 0,96, egy N.C = 6; és 0,88 egy 4 ° C-on.
egységek
Az N.C értékek közül 12-nél számos táblázatot építettek, amelyek összehasonlítják a periódusos rendszer összes elemének atom sugarát.
Mivel nem mindegyik elem alkot ilyen kompakt struktúrát (N.C kevesebb mint 12), az V. Goldschmidt kapcsolatát az atomi sugárok kiszámítására használják, és ugyanazt a csomagolást fejezik ki. Ily módon az atom sugarak mérése standardizált.
De milyen egységekben fejezik ki magukat? feltéve, hogy d nagyon kis mértékű, az Å (10 ∙ 10-10m) vagy széles körben használt, a pikométer (10 ∙ 10-12m).
Hogyan változik az időszakos táblázatban?
Egész idő alatt
A fémes elemek számára meghatározott atomsugárzatok fém sugarak nevét kapják, míg ezeknek a nemfémes elemeknek a kovalens sugara (pl. Foszfor, P).4, vagy a kén, S8). Mindazonáltal mindkét típusú rádió között kiemelkedőbb különbség van, mint a név.
Balról jobbra ugyanabban az időszakban a mag protonokat és elektronokat ad hozzá, de ez utóbbi ugyanazon az energiaszintre korlátozódik (fő kvantumszám). Ennek következtében a mag növekvő hatékony nukleáris töltést fejt ki a valenciaelektronoknál, amelyek az atomsugarat megkötik.
Ily módon a nemfémes elemek ugyanabban az idõszakban atomi (kovalens) sugaraiknál kisebbek, mint a fémek (fém sugár).
Csökken egy csoport
Amikor egy csoport csökkenőben van, új energiaszintek vannak engedélyezve, amelyek lehetővé teszik az elektronok több helyet. Így az elektronikus felhő nagyobb távolságokat fed le, homályos perifériája végül jobban elhúzódik a magból, ezért az atomsugár kitágul.
Lantanid összehúzódás
A belső réteg elektronjai segítenek megvédeni a valens elektronok hatékony nukleáris töltését. Amikor a belső rétegeket alkotó pályáknak sok "lyukuk" van (csomópontja), mint az f orbitálisoknál, a mag erősen kötődik az atom sugarához az orbiták rossz árnyékoló hatása miatt..
Ezt a tényt a periódusos táblázat 6-os periódusának lantanid-összehúzódása igazolja. La-tól Hf-hez jelentősen csökken az f-es orbiták által létrehozott atomi sugár, amely „feszül fel”, amikor az f-en áthalad a lantánoidok és az aktinoidok blokkján..
Hasonló hatás figyelhető meg a p blokk elemeivel a 4. periódusból. Ezúttal az orbiták gyenge árnyékoló hatásának eredménye, amely feltöltődik az átmeneti fémek periódusai átlépésekor..
Példák
A periódusos rendszer 2. periódusának elemeinek atomi sugara:
-Li: 257 pm
-Legyen: 112 óra
-B: 88 óra
-C: 77 óra
-N: 74 óra
-O: 66 óra
-F: 64: 00.
Ne feledje, hogy a lítiumfém a legnagyobb atommagja (257 p.m), míg a periféria jobb szélén található fluor a legkisebb (64 p.m.). Ugyanezen időszakban az atom sugara balról jobbra esik, és a felsorolt értékek azt mutatják.
Lítium, fémkötések kialakításával, sugara fém; és fluor, mivel kovalens kötéseket (F-F) képez, annak sugara kovalens.
És ha az atom rádiókat angstrom egységben szeretné kifejezni? Egyszerűen ossza meg őket 100-al: (257/100) = 2,57Å. És így tovább a többi értékkel.
referenciák
- Kémia 301. Atomic Radii. A lap eredeti címe: ch301.cm.utexas.edu
- CK-12 Alapítvány. (2016. június 28.). Atom sugár. Lap forrása: chem.libretexts.org
- Az atomi sugárzás trendjei. Készült: intro.chem.okstate.edu
- Clackamas Közösségi Főiskola. (2002). Atom méret. Lap forrása: dl.clackamas.edu
- Clark J. (2012. augusztus). Atomikus és ionos sugár. Lap forrása: chemguide.co.uk
- Shiver & Atkins. (2008). Szervetlen kémia (Negyedik kiadás., 23., 24., 80., 169. o.). Mc Graw-hegy.


