Szerves sók fizikai és kémiai tulajdonságai, felhasználása és példái
az szerves sók sűrű számú számtalan jellemzővel rendelkező ionos vegyület. Korábban egy olyan szerves vegyületből származnak, amely olyan átalakításon ment keresztül, amely lehetővé teszi, hogy töltőanyagot hordozzon, és kémiai identitása is függ a kapcsolódó iontól..
Az alábbi képen a szerves sók két nagyon általános kémiai képlete látható. Az első, R-AX, olyan vegyületként értelmezhető, amelynek szén-szerkezete egy atom, vagy az A csoport pozitív töltést + vagy negatív (-) hordoz.
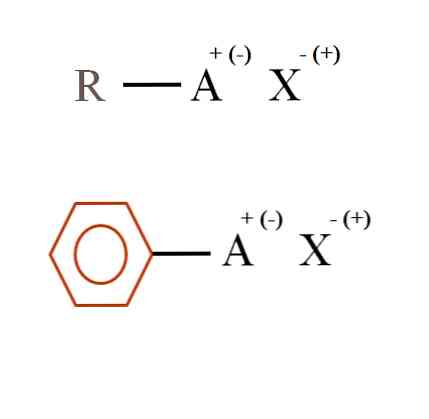
Amint látható, van egy kovalens kötés R és A, R-A között, de viszont az A formális töltés vonzza az X iont (vagy visszavonja)..
Ha az A pozitív volt, hány X-t tudott kölcsönhatásba lépni? Csak egy, az elektroneutrális elv (+ 1-1 = 0) alapján. Mi azonban az X identitása? Az X anion lehet a CO32-, két kation szükséges RA+; halogénatom: F-, Cl-, Br-, stb .; vagy akár egy másik RA vegyület-. A lehetőségek kiszámíthatatlanok.
Szintén egy szerves só lehet aromás jellegű, a barna benzolgyűrűben látható. A réz-benzoát-só (II), (C)6H5COO)2A Cu például két aromás gyűrűből áll, amelyek negatív töltésű karboxilcsoportokkal rendelkeznek, amelyek kölcsönhatásba lépnek a kationokkal.2+.
index
- 1 Fizikai és kémiai tulajdonságok
- 1.1 Nagy molekulatömeg
- 1.2 Amfipil és felületaktív anyagok
- 1.3 Magas forráspont vagy olvadáspont
- 1.4. Savasság és bázisosság
- 2 Használat
- 3 Példák a szerves sókra
- 3.1 Karboxilátok
- 3.2 Lítium-diacril -uprátok
- 3.3 A szulfonium sói
- 3.4 Az oxonium sói
- 3.5 Aminsók
- 3.6 Diazóniumsók
- 4 Referenciák
Fizikai és kémiai tulajdonságok
A képből megállapítható, hogy a szerves sók három komponensből állnak: a szerves, R vagy Ar (aromás gyűrű), egy atom vagy csoport, amely az A töltést hordozza, és egy ellenion X..
Csakúgy, mint a kémiai identitás és a szerkezet az ilyen összetevők által definiáltak, így tulajdonságaik ezektől függenek.
Ebből a tényből összefoglalhatók bizonyos általános tulajdonságok, amelyek megfelelnek ezeknek a sóknak a túlnyomó többségének.
Nagy molekulatömeg
Feltételezve, hogy mono- vagy többértékű szervetlen X anionok, a szerves sók általában sokkal nagyobb molekulatömeggel rendelkeznek, mint a szervetlen sók. Ennek oka főként a szénváz, amelynek egyszerű C-C kötései és hidrogénatomjai nagy mennyiségben járulnak hozzá a vegyülethez.
Ezért R vagy Ar felelős a nagy molekulatömegért.
Amfipil és felületaktív anyagok
A szerves sók amfifil vegyületek, azaz szerkezeteik mind hidrofil, mind hidrofób végekkel rendelkeznek.
Mik ezek a szélsőségek? R vagy Ar jelentése hidrofób vég, mivel C- és H-atomjaiknak nincs nagy affinitása a vízmolekulákhoz.
A+(-), a töltést hordozó atom vagy csoport a hidrofil vég, mivel hozzájárul a dipoláris pillanathoz és kölcsönhatásba lép a vízképző dipolákkal (RA+ OH2).
Amikor a hidrofil és hidrofób régiók polarizáltak, az amfifil só felületaktív anyaggá válik, amely a mosószerek előállításához széles körben használt anyag. demulgátorokat.
Magas forráspont vagy olvadáspont
A szervetlen sókhoz hasonlóan a szerves sók magas olvadási és forrási pontokkal rendelkeznek a folyékony vagy szilárd fázisban lévő elektrosztatikus erők miatt..
Azonban R vagy Ar szerves komponenssel, Van der Waals más típusú erővel (londoni erők, dipol-dipol, hidrogénhidak), amelyek bizonyos módon versenyeznek elektrosztatikus.
Ezért a szerves sók szilárd vagy folyékony szerkezetei először bonyolultabbak és változatosabbak. Némelyikük is viselkedik folyékony kristályok.
Savasság és alaposság
A szerves sók általában erősebb savak vagy bázisok, mint a szervetlen sók. Ez azért van, mert A, például az amin sókban, egy további hidrogénnel való kötődése miatt pozitív töltéssel rendelkezik: A+-H. Ezután egy bázissal érintkezve adjon a protonnak, hogy visszatérjen semleges vegyületté:
RA+H + B => RA + HB
A H az A-hoz tartozik, de azt írja, ahogy a semlegesítési reakcióba lép.
Másrészt, RA+ lehet egy nagy molekula, amely nem képes szilárd anyagot képezni egy olyan kristályos hálózattal, amely a hidroxil-anion vagy a hidroxil-OH-csoport elégséges stabilitásával rendelkezik.-.
Ebben az esetben a só RA+OH- úgy viselkedik, mint egy erős bázis; akár bázikus, mint NaOH vagy KOH:
RA+OH- + HCI => RACl + H2O
Figyeljük meg a Cl anion kémiai egyenletét- helyettesíti az OH-t-, az RA képződése+Cl-.
alkalmazások
A szerves sók alkalmazása az R, Ar, A és X azonosságától függően változik. Továbbá, az alkalmazás, amelyre a céljuk van, attól is függ, hogy milyen típusú szilárd vagy folyékony. E tekintetben néhány általános jellegű:
-Ezek reagensekként szolgálnak más szerves vegyületek szintéziséhez. A RAX az R-lánc "donoraként" működhet, amelyet egy másik, a jó kimenő csoportot helyettesítő vegyülethez kell hozzáadni.
-Ezek felületaktív anyagok, így kenőanyagként is használhatók. Erre a célra a karboxilátok fém sói alkalmazhatók.
-Lehetővé teszik a színezékek széles skálájának szintetizálását.
A szerves sók példái
karboxilátok
A karbonsavak egy hidroxiddal reagálnak egy semlegesítési reakcióban, ami a karboxilátok sóit eredményezi: RCOO- M+; ahol M+ Lehet bármilyen fémkation (Na+, Pb2+, K+, stb.) vagy az NH ammónium-kation4+.
A zsírsavak hosszú szénláncú alifás karbonsavak, telítettek és telítetlenek lehetnek. A palmitinsav (CH) a telített3(CH2)14COOH). Ez a palmitát sót, míg a sztearinsavat (CH3(CH2)16A COOH a sztearát-sót képezi. A szappanok ezekből a sókból állnak.
A benzoesav esetében C6H5COOH (ahol C6H5- benzolgyűrű), ha bázissal reagál, képezi a benzoát sókat. Minden karboxilátban a -COO csoport- A (RAX).
Lítium-diacupuprates
A lítium-diacuprát a szerves szintézisben hasznos. A képlete [R-Cu-R]-Li+, amelyben a réz atom negatív töltéssel rendelkezik. Itt a réz az A atomja.
Szulfóniumsók
Ezeket egy szerves szulfid és egy alkil-halogenid reakciójával állítjuk elő:
R2S + R'X => R2R'S+X
Ezen sók esetében a kénatom pozitív formális töltést hordoz (S+) három kovalens kötéssel rendelkezik.
Oxóniumsók
Továbbá az éterek (a szulfidok oxigénezett analógjai) reagálnak a hidridekkel az oxóniumsók képzése céljából:
ROR '+ HBr <=> RO+HR '+ Br-
A HBr savas protonja kovalensen kötődik az éter oxigénatomjához (R2O+-H), pozitívan betöltve.
Aminsók
Az aminok lehetnek primer, szekunder, tercier vagy kvaterner, valamint sóik. Mindegyiküket a nitrogénatomhoz kapcsolódó H-atom jellemzi.
Szóval, RNH3+X- ez egy primer amin só; R2NH2+X-, szekunder aminból; R3NH+X-, tercier amin; és R4N+X-, kvaterner amin (kvaterner ammóniumsó).
Diazóniumsók
Végül a diazóniumsók (RN2+X-) vagy arildiazonium (ArN)2+X-), számos szerves vegyület, különösen az azofestékek kiindulási pontját jelentik.
referenciák
- Francis A. Carey. Szerves kémia (Hatodik kiadás, Pp. 604-605, 697-698, 924). Mc Graw-hegy.
- Graham Solomons T. W., Craig B. Fryhle. Szerves kémia. Aminok. (10. kiadás). Wiley Plus.
- Wikipedia. (2018). Só (Kémia). Készült: en.wikipedia.org
- Steven A. Hardinger. (2017). A szerves kémia illusztrált szószedete: sók. Lap forrása: chem.ucla.edu
- Chevron Oronite. (2011). Karboxiiátok. [PDF]. Letöltve: oronite.com


