Etil-éter tulajdonságai, szerkezete, előállítása, felhasználása
az etil-éter, dietil-éter néven ismert szerves vegyület, amelynek kémiai képlete C4H10O. Jellemzője, hogy színtelen és illékony folyadék, ezért palackjait a lehető legjobban zárva kell tartani.
Ezt az étert a dialkil-éterek tagjaként osztályozzuk; azaz ROR ', ahol R és R' jelentése különböző szénszegmensek. És ahogyan a középső nevét, a dietil-étert írja le, két radikális-etilcsoport, amelyek az oxigénatomhoz kötődnek.

Kezdetben etil-étert használtak általános érzéstelenítőszerként, amelyet William Thomas Green Morton 1846-ban vezetett be. A gyúlékonysága miatt azonban használatát elutasították, más kevésbé veszélyes érzéstelenítőkkel helyettesítve..
Ezt a vegyületet használták a vérkeringés idejének becslésére a betegek szív- és érrendszeri állapotának értékelése során.
A testen belül a dietil-éter szén-dioxiddá és metabolitokká alakítható; az utóbbi a vizelettel ürül. Azonban a beadott éter nagy része kilégzésre kerül a tüdőben, anélkül, hogy bármilyen módosítást végezne.
Másrészt szappanok, olajok, parfümök, alkaloidok és gumik oldószereként használják.
index
- 1 Az etil-éter szerkezete
- 1.1 Intermolekuláris erők
- 2 Fizikai és kémiai tulajdonságok
- 2.1 Egyéb nevek
- 2.2 Molekuláris képlet
- 2.3 Molekulatömeg
- 2.4 Fizikai megjelenés
- 2.5 Szag
- 2.6 Íz
- 2.7 Forráspont
- 2.8 Olvadáspont
- 2.9 Lobbanáspont
- 2.10 Oldhatóság vízben
- 2.11 Oldhatóság más folyadékokban
- 2.12 Sűrűség
- 2.13 Gőzsűrűség
- 2.14 Gőznyomás
- 2.15 Stabilitás
- 2.16 Automatikus gyújtás
- 2.17 Bomlás
- 2.18 Viszkozitás
- 2.19 Az égési hő
- 2.20 Párolgási hő
- 2.21 Felületi feszültség
- 2.22 Ionizációs potenciál
- 2.23 Szagküszöbérték
- 2.24 Törésmutató
- 3 Megszerzés
- 3.1 Etilalkoholból
- 3.2 Az etilénből
- 4 Toxicitás
- 5 Felhasználások
- 5.1 Szerves oldószer
- 5.2 Általános érzéstelenítés
- 5.3 Az éter szelleme
- 5.4 A vérkeringés értékelése
- 5.5 Tanító laboratóriumok
- 6 Referenciák
Az etil-éter szerkezete
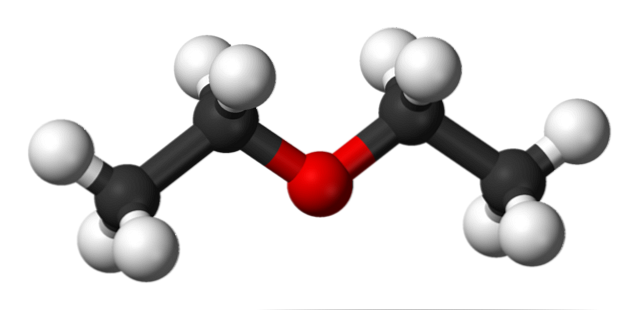
A fenti ábrán bemutatjuk az etil-éter molekulaszerkezetének gömbölyűségét és sávjait.
Mint látható, az oxigénatomnak megfelelő piros gömbnek két etil-csoportja van, amelyek mindkét oldalon kapcsolódnak. Minden összeköttetés egyszerű, rugalmas és szabadon forgatható a tengelyek körül.
Ezek a forgások a konformerekként ismert sztereoizomerekből származnak; az izomereknél több alternatív térbeli állapot. A kép szerkezete pontosan megfelel az anti-konformernek, amelyben az atomok összes csoportja el van osztva (egymástól elválasztva).
Mi lenne a másik konformer? Az elhomályosodott, és bár a képed nem érhető el, csak U formájúvá tesszük, az U felső végén pedig a metilcsoportok találhatók, -CH3, amelyek sztérikus visszataszításokat tapasztalnának (ők egymásba ütköznek).
Ezért várható, hogy a CH molekula3CH2OCH2CH3 az anti-konformációt az idő nagy részében fogadja el.
Intermolekuláris erők
Milyen intermolekuláris erők a folyékony fázisban lévő etil-éter molekulái? A folyadékot főleg a diszperziós erőknek köszönhetjük, mivel a dipol pillanatuk (1.5D) nem rendelkezik olyan térséggel, amely eléggé hiányos az elektronikus sűrűségben (δ +)
Ez azért van, mert az etilcsoportok egyetlen szénatomja sem ad túl sok elektron-sűrűséget az oxigénatomhoz. A fentiek nyilvánvalóak az etil-éter elektrosztatikus potenciáljának térképén (alsó kép). Vegye figyelembe a kék régió hiányát.
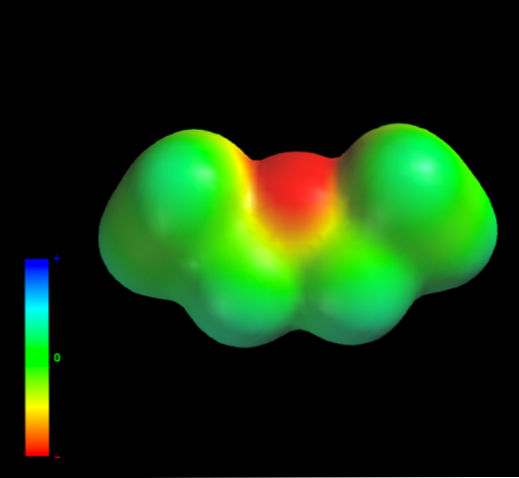
Az oxigén nem képezhet hidrogénkötéseket sem, mert a molekulaszerkezetben nincsenek O-H kötések. Ezért a pillanatnyi dipolok és azok molekulatömege kedvező a diszperziós erőkre.
Ennek ellenére erősen oldódik vízben. Miért? Minthogy az oxigénatom nagyobb elektron-sűrűséggel rendelkezik, a vízmolekulából hidrogénkötéseket fogadhat el:
(CH3CH2)2Oδ- - δ+H-OH
Ezek az interakciók felelősek 6,04 g ennek az éternek a feloldásáért 100 ml vízben.
Fizikai és kémiai tulajdonságok
Más nevek
-Dietil-éter
-etoxi
-Etil-oxid
Molekuláris képlet
C4H10O vagy (C2H5)2O.
Molekulatömeg
74,14 g / mol.
Fizikai megjelenés
Színtelen folyadék.
szag
Édes és fűszeres.
aroma
Égő és édes.
Forráspont
94,6 ° C (34,6 ° C) és 760 Hgmm közötti.
Olvadáspont
-177,3 ° F (-116,3 ° C). Stabil kristályok.
Gyújtási pont
-49ºF (zárt tartály).
Oldhatóság vízben
6,04 g / 100 ml 25 ° C-on.
Oldhatóság más folyadékokban
Rövid láncú alifás alkoholokkal, benzollal, kloroformmal, petroléterrel, zsír oldószerrel, sok olajjal és tömény sósavval elegyíthető.
Acetonban oldódik és etanolban nagyon jól oldódik. A benzinben, benzolban és olajokban is oldódik.
sűrűség
0,714 mg / ml 68 ° F-on (20 ° C).
Gőzsűrűség
2,55 (az 1-es sűrűségű levegő tekintetében).
Gőznyomás
442 mmHg 68 ° F-on. 538 mmHg 25 ° C-on 58,6 kPa 20 ° C-on.
stabilitás
Lassan oxidálódik a levegő, a nedvesség és a fény hatása a peroxidok képződésével.
A peroxidok képződését éteres tartályokban lehet előállítani, amelyek több mint hat hónapig tárolódnak. A peroxidok súrlódással, ütéssel vagy melegítéssel detonálhatnak.
Kerülni kell az érintkezést a következővel: cink, halogének, nemfémes oxihalidok, erős oxidálószerek, króm-klorid, tementinolajok, nitrátok és fémkloridok.
Automatikus gyújtás
356ºF (180 ° C).
bomlás
Felmelegedéskor bomlik, csípős és irritáló füstöt bocsát ki.
viszkozitás
0,2448 cPoise 20 ° C-on.
Az égési hő
8,807 Kcal / g.
Párolgási hő
89,8 cal / g 30 ° C-on.
Felületi feszültség
17,06 din / cm 20 ° C-on.
Ionizációs potenciál
9,53 eV.
Szagküszöb
0,83 ppm (a tisztaság nincs megadva).
Törésmutató
1 355 ° C-on 15 ° C-on.
megszerzése
Etil-alkoholból
Az etil-étert etil-alkoholból nyerhetjük kénsav katalizátor jelenlétében. A kénsav egy vizes közegben disszociál a hidroniumion előállítására, H3O+.
A vízmentes etil-alkohol átáramlik a kénsavoldatban, 130 ° C és 140 ° C közötti hőmérsékleten melegszik, és így etil-alkohol molekulák protonálódását eredményezi. Ezt követően egy másik, nem protonált etil-alkohol molekula reagál a protonált molekulával.
Amikor ez megtörténik, az etil-alkohol második molekulájának nukleofil támadása elősegíti a víz felszabadulását az első molekulából (a protonált); ennek eredményeképpen egy protonált etil-éter képződik (CH3CH2OHCH2CH3), részben feltöltött oxigénnel pozitív.
Ez a szintézis azonban elveszíti a hatékonyságot, mivel a kénsavat az eljárás során előállított vízzel hígítjuk (etil-alkohol dehidratálódása)..
A reakció hőmérséklete kritikus. 130 ° C alatti hőmérsékleten a reakció lassú, és a legtöbb esetben etil-alkoholt desztillálunk.
150 ° C fölött a kénsav etilént képez, az etil-éterrel etil-étert képezve..
Az etilénből
Az ellentétes eljárásban, azaz az etilén hidratálása gőzfázisban, etil-éter képződhet melléktermékként az etil-alkohol mellett. Valójában ez a szintetikus út ennek a szerves vegyületnek a nagy részét eredményezi.
Ez az eljárás szilárd hordozóra rögzített foszforsav-katalizátorokat használ, amelyek képesek több éter előállítására.
Az etanol gőzfázisban történő dehidratálása alumínium-oxid katalizátorok jelenlétében 95% -os hozamot adhat az etil-éter előállításához..
toxicitás
Érintkezéskor irritációt okozhat a bőrön és a szemen. A bőrrel való érintkezés megszáradhat és megrepedhet. Az éter általában nem jut be a bőrbe, mivel gyorsan elpárolog.
Az éter által okozott szemirritáció általában enyhe, és súlyos irritáció esetén a károsodás általában visszafordítható..
Lenyelése kábító hatással és gyomor irritációval jár. A súlyos lenyelés vesekárosodást okozhat.
Az éter belégzése az orr és a torok irritációját okozhatja. Éter belélegzése esetén: álmosság, izgalom, szédülés, hányás, szabálytalan légzés és fokozott nyálkásodás.
A magas expozíció eszméletvesztést és akár halált is okozhat.
Az OSHA egy 8 órás műszak alatt átlagosan 800 ppm-es munkahelyi expozíciós határértéket állapít meg.
A szemirritáció szintje: 100 ppm (humán). Szemirritáció szintje: 1200 mg / m3 (400 ppm).
alkalmazások
Szerves oldószer
Ez egy szerves oldószer, amelyet a bróm, jód és más halogének feloldására használnak; a lipidek (zsírok), gyanták, tiszta gumik, néhány alkaloid, gumi, parfüm, cellulóz-acetát, cellulóz-nitrát, szénhidrogének és festékek többsége.
Ezenkívül az állati szövetek és növények hatóanyagainak extrakciójához használatos, mivel alacsonyabb sűrűségű, mint a víz, és úszik rajta, így a kívánt anyagokat az éterben oldjuk..
Általános érzéstelenítés
1840 óta általános anesztetikumként alkalmazzák, a kloroformot pedig terápiás előnyökkel helyettesíti. Ez azonban gyúlékony anyag, és ezért komoly nehézségekkel szembesül a klinikai környezetben történő alkalmazás során.
Ezenkívül a betegeknél néhány nemkívánatos mellékhatást, például hányingert és hányást okozhat.
Ezen okok miatt az étert általános érzéstelenítőszerként eldobottuk, és más anesztetikumokkal, például halotánnal helyettesítettük..
Az éter szelleme
Az etanollal összekevert étert az éter-éter nevű oldat kialakításához használtuk, melyet a gyomorpanaszlás és a gyomorhártya enyhébb formáinak kezelésére használtak..
A vérkeringés értékelése
Az étert a kar és a tüdő közötti vérkeringés értékelésére használják. Az étert egy karba injektáljuk, a vért a jobb pitvarba, majd a jobb kamrába, és onnan a tüdőbe helyezzük..
Az éter befecskendezésétől az éterszag felvételéig a kilégzett levegőben eltelt idő körülbelül 4-6 s..
Tanító laboratóriumok
Az étert számos laboratóriumi laboratóriumban használják; például Mendel genetikai törvényeinek bemutatásakor.
Az étert a Drosophila nemzetség legyeinek zsibbadására használják, és lehetővé teszik a szükséges kereszteződéseket a genetika törvényeinek bizonyítása érdekében.
referenciák
- Graham Solomons T. W., Craig B. Fryhle. (2011). Szerves kémia. Aminok. (10th kiadás.). Wiley Plus.
- Carey F. (2008). Szerves kémia (Hatodik kiadás). Mc Graw-hegy.
- A Sevier. (2018). Dietil-éter. Science Direct. Visszaváltva: sciencedirect.com
- Az Encyclopaedia Britannica szerkesztői. (2018). Etil-éter. Britannica ncyclopædia. A lap eredeti címe: britannica.com
- PubChem (2018). Éter. Lap forrása: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Dietil-éter. Lap forrása: en.wikipedia.org
- Biztonsági lap XI: etil-éter. [PDF]. Helyreállítás: quimica.unam.mx


