Spore festő alapítvány, technikák és felhasználások
az spórafestés az a módszer, amelyet a rezisztencia-struktúrák színezésére használnak, amelyek bizonyos baktérium-nemzetségeket alkotnak, ha kedvezőtlen körülmények között vannak; ezek a struktúrák megfelelnek a túlélés módjának.
Sok nemzetség van, amely spórákat alkot; a főbbek azonban a Bacillus és a Clostridium. Ezeket a nemzetségeket sokkal relevánsabbnak tekintik, mert patogén fajuk van az emberek számára.
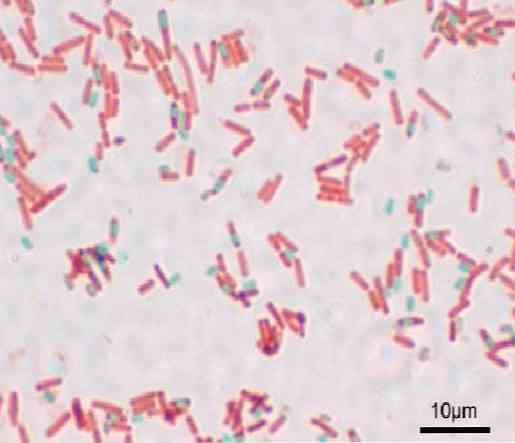
Minden bacillus egy spórát okozhat. A készítmény festése idején a spórát a bacillus (endospore) vagy annak külső részén (exospore) találhatjuk. A baktériumok szokásos festési technikáival - mint például a Gram festékkel - a spórák színtelenek maradnak.
Jelenleg számos színező módszer létezik, amelyek képesek áthatolni a spóra vastag szerkezetét annak festésére. Ezek a módszerek nagyon változatosak; ezek közül említhetjük a Dorner-technikát, a Möeller-foltot és a Shaeffer-Fulton-módszert, amelyet Wirtz-Conklin néven is ismertek..
Az említett technikák közül a Shaeffer-Fulton módszertan a leggyakrabban használt rutin laboratóriumokban. Nevét két mikrobiológusnak köszönheti, akik 1930-ban alkották meg a színezést: Alicia Shaeffer és MacDonald Fulton. Néha azonban a technikát Wirtz-Conklinnak nevezik az 1900-as évek két bakteriológusának tiszteletére.
index
- 1 Alapítvány
- 2 Spore színező technikák
- 2.1 Dorner technikája
- 2.2 Módosított Dorner technika
- 2.3 Shaeffer-Fulton vagy Wirtz-Conklin technikája
- 2.4 Möeller technika
- 2.5 Módosított Möeller technika hő nélkül
- 3 Használat
- 3.1 Példák
- 4 Referenciák
alapítvány
A spórák nem festenek hagyományos színezéseket, mert nagyon vastag faluk van. A spórák összetett összetétele megakadályozza a legtöbb festék belépését.
Ha a spórákat kívülről tanulmányozzák, a következő rétegek figyelhetők meg: először az exosporium, amely a glikoproteinek által képzett legvékonyabb külső réteg..
Ezután jön a kutikula, amely ellenáll a magas hőmérsékletnek, majd a peptidoglikánból álló kéreg. Aztán ott van a bázis fala, amely megvédi a protoplasztot.
A spóra egy dehidratált szerkezet, amely 15% kalciumot és dipikolin-savat tartalmaz. Ezért a legtöbb spóra színező technika a hő alkalmazásán alapul, így a festék behatolhat a vastag szerkezetbe.
Miután a spórát festették, nem tudja megszüntetni a festéket. A Shaeffer-Fulton technikában a malachit zöld belép a vegetatív sejtekbe, és hő alkalmazása után behatol az endospórába és az exosporokba is..
Vízzel való mosáskor a festéket eltávolítják a vegetatív sejtből. Ez azért fordul elő, mert a zöld malachit festék kissé bázikus, ezért gyengén kötődik a vegetatív sejthez.
Másrészről, nem tud kijutni a spórából, és végül a szafraninnal rendelkező bacillus ellentétes. Ez az alapítvány a többi technikára érvényes, amelyben valami hasonló történik.
Spore színező technikák
Annak érdekében, hogy a spórák foltok legyenek, a gyanús gyanús törzs tiszta kultúrájával kell rendelkeznie.
A tenyészetet 24 órán át extrém hőmérsékletnek vetjük alá, hogy stimuláljuk a mikroorganizmus sporulálódását. Ehhez a tenyészetet 44 ° C-os kemencébe vagy 8 ° C-os hűtőszekrénybe helyezhetjük 24 vagy 48 órán át.
Ha túl sok idő marad a megemlített hőmérsékleten, csak exosporok figyelhetők meg, mivel az összes endoszkóp elhagyja a bacillust.
Az idő végén néhány csepp steril fiziológiai oldatot egy tiszta csúszdára kell helyezni. Ezután a termés egy kis részét veszik fel, és finom eloszlás készül.
Ezután megszárad, majd a hőre rögzül, és az alábbiakban ismertetett technikákkal festik:
Dorner technikája
1. Készítsünk egy kémcsőben koncentrált szuszpenziót a sporulált mikroorganizmusból desztillált vízben, és adjunk hozzá azonos térfogatú szűrt Kinyoun fenolos fukszint.
2- Helyezze a csövet forró vízzel fürdőbe 5-10 percig.
3- Egy tiszta lemezen keverjen össze egy csepp előző szuszpenziót egy csepp 10% -os nigrosin vizes oldattal, főzzük és szűrjük.
4- Gyors melegítéssel hosszabbítsa meg és szárítsa meg.
5- 100X objektív vizsgálata (merítés).
A spórák pirossá válnak, és a baktériumsejtek szinte szürkésnek tűnnek sötét szürke háttérrel szemben.
Módosított Dorner technika
1 - A sporulált mikroorganizmus szuszpenziója egy lemezre terjed, és a hőre rögzül.
2- A mintát szűrőpapír csíkkal borítjuk, amelyhez fenoesav-fukszint adunk. A festéket 5-7 percig melegítjük a Bunsen égő lángjával, amíg a gőzök felszabadulnak. Ezután eltávolítjuk a papírt.
3 - A készítményt vízzel mossuk, majd nedvszívó papírral szárítjuk.
4- Fedjük le a kenetet 10% -os nigrosin vékony filmrel, a második csúszkával a nigrosin vagy a tű elterjedéséhez..
A spórák és a baktériumok színezése megegyezik a technika állása szerinti eljárással.
Shaeffer-Fulton vagy Wirtz-Conklin technika
1- Vékonyan szórjunk a szuszpenzióba a sporulált mikroorganizmus szuszpenziójával, és rögzítsük a hőre.
2- Fedje le a lemezt egy 5% -os malachit zöld oldattal (szűrőpapír helyezhető a lapra).
3- Melegítsük a Bunsen égő lángját, hogy gőz kerüljön ki, és eltávolítsa a lángot. Ismételje meg a műveletet 6-10 percig. Ha az eljárás során a malachit zöld oldat túlságosan elpárolog, többet lehet hozzáadni.
4- Távolítsa el a szűrőpapírt (ha elhelyezte) és mossa le vízzel.
5- Fedjük le a lemezt 0,5% -os vizes szafraninnal 30 másodpercig (a technika egyes változatai 0,1% -os vizes szafranint használnak, és 3 percig hagyják)..
Ezzel a technikával a spórák zöldek és a bacillák vörösek.
Ennek az a hátránya, hogy a fiatal kultúrák endoszporái nem foltosak jól, mert rendkívül tiszta vagy színtelen. Ennek elkerülése érdekében ajánlott 48 órás inkubációs tenyészetet használni.
Möeller technika
1- 2 percig fedjük le a kenetet kloroformmal.
2- A kloroformot dobja ki.
3 - 5 percig fedjük le 5% krómsavval.
4- Mossuk le desztillált vízzel
5- A lapot fuchsin-fenolos ponty borítja, és a gőzök kibocsátásáig a Bunsen égő lángjával érintkezik; aztán néhány pillanatig eltávolítják a lángból. A műveletet addig ismételjük, amíg el nem éri a 10 percet.
6- Mossa vízzel.
7- Használjon savanyított etanolt (sósav-alkohol) a színtelenítéshez. 20 vagy 30 másodpercig marad.
8- Mossuk le desztillált vízzel.
9 - A lapot metilénnel 5 percen át ellensúlyozza.
10- Desztillált vízzel mossuk.
11- Szárításra kerül, és a mintát mikroszkóp alatt veszik.
A spórák vörös és kék bacillák. Fontos, hogy ne lélegezzük be a gőzöket, mert mérgezőek, és hosszú távon rákkeltő lehetnek.
Módosított Möeller technika hő nélkül
2007-ben Hayama és munkatársai a Möeller-technikát módosították. Eltávolították a festék fűtési lépését, és 2 csepp Tergitol 7 felületaktív anyag hozzáadásával helyettesítették minden 10 ml fuchsin-fenolos karbololdathoz. Ugyanezeket az eredményeket kaptuk.
alkalmazások
A spórák színezése nagyon értékes és hasznos információt nyújt a kórokozó azonosításához, mivel ugyanaz, annak alakja, helye a bacillusban és a vegetatív sejt deformálásának képessége, vagy nem, az a fajta adat, amely irányíthatja a fajt. egy adott nemben.
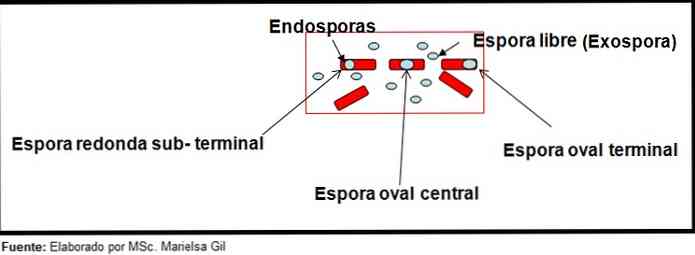
Ebben az összefüggésben érdemes megemlíteni, hogy a spórák lehetnek kerekek vagy oválisak, lehetnek a központban vagy a paracentrális, szubterminális vagy terminális helyzetben is..
Példák
- Clostridium difficile ovális spórát képez, amely a bacillust deformálja.
- A spórája Clostridium tertium Ez ovális, nem deformálja a bacillust, és a terminál szintjén helyezkedik el.
- Az endospórus Clostridium tetani végberendezés és deformálja a bacillust, ami egy dobos megjelenését adja.
- A spórák Clostridium botulinum, C. hisztolitikoiizin, C. Novy és C. septicum kerek vagy szubterminális ovális és deformálják a bacillust.
- Az endospórus Clostridium sordelli központi helyzetben van, enyhe deformációval.

referenciák
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. A baktérium spórák festésére szolgáló egyszerűsített technika javaslata a Moeller módszerének hő-sikeres módosítása nélkül. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Wikipédia közreműködők. Moeller folt. Wikipédia, The Free Encyclopedia. 2018. november 3., 03:28 UTC. Elérhető: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Mikrobiológiai technológiai kézikönyv. Alaptudományi Tanszék Mikrobiológiai Akadémia. Nemzeti Műszaki Intézet.
- „Endospórafestéket.” Wikipédia, A szabad enciklopédia. Február 25, 10:20 UTC. 2019. január 10., 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J és munkatársak. (2006). Az Extremadura autonóm közösség munkatársai. Különleges napirend IV. Szerkesztői MAD. Sevilla-Spanyolország, 211-212. Oldal.
- Silva M, García M, Corrales J, Ponce E. (2006), laboratóriumi szakember, a galíciai egészségügyi szolgálat (SERGAS). Tárgyspecifikus kötet 2. Szerkesztői MAD. Sevilla-Spanyolország, 79-80. Oldal.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiológiai diagnózis. (5. kiadás). Argentína, szerkesztő Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott mikrobiológiai diagnózisa. 12 ed. Argentínában. Panamericana S.A szerkesztő


