Ciklohexén szerkezet, tulajdonságok, szintézis és felhasználás
az ciklohexén egy alkén vagy ciklusos olefin, amelynek molekuláris képlete C6H10. Színtelen folyadékból áll, amely vízben nem oldódik és számos szerves oldószerrel elegyedik. Jellemzője, hogy gyúlékony, és a természetben általában a kőszénkátrányban található..
A ciklohexént benzol részleges hidrogénezésével és az alkohol-ciklohexanol dehidratálásával állítjuk elő; azaz egy rozsdásabb forma. A többi cikloalkénhez hasonlóan az elektrofil addíció és a szabad gyökök reakciói is jelentkeznek; például a halogénezési reakció.
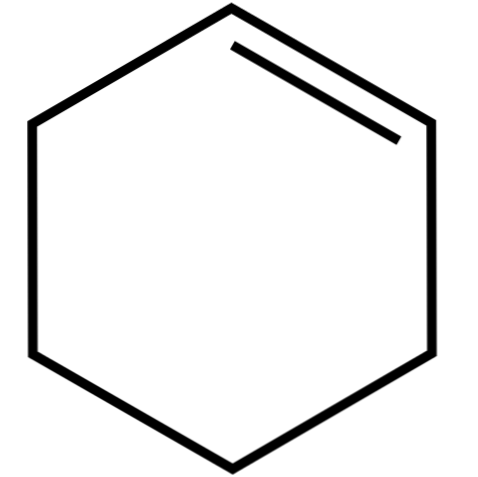
Ez a ciklusos alkén (felső kép) azeotróp keverékeket képez (nem különíthető el desztillációval), alacsonyabb alkoholokkal és ecetsavval. Hosszú tárolás esetén nem stabil, mivel napfény és ultraibolya sugárzás hatására bomlik.
A ciklohexént oldószerként használják, ezért számos alkalmazási területtel rendelkezik, mint például a magas oktánszámú gázolajok stabilizálása és az olajok kivonása..
De a legfontosabb dolog, hogy a ciklohexén köztes és nyersanyagként szolgál számos hasznos vegyület előállításához, köztük: ciklohexanon, adipinsav, maleinsav, ciklohexán, butadién, ciklohexil-karbonsav, stb..
index
- 1 A ciklohexén szerkezete
- 1.1 Intermolekuláris kölcsönhatások
- 2 Tulajdonságok
- 2.1 Kémiai nevek
- 2.2 Molekulatömeg
- 2.3 Fizikai megjelenés
- 2.4 Szag
- 2.5 Forráspont
- 2.6 Olvadáspont
- 2.7 Lobbanáspont
- 2.8 Oldhatóság vízben
- 2.9 Oldhatóság szerves oldószerekben
- 2.10 Sűrűség
- 2.11 Gőzsűrűség
- 2.12 Gőznyomás
- 2.13 Öngyulladás
- 2.14 Bomlás
- 2.15 Viszkozitás
- 2.16 Az égési hő
- 2.17 Párolgási hő
- 2.18 Felületi feszültség
- 2.19 Polimerizáció
- 2.20 Szagküszöbérték
- 2.21 Refraktív index
- 2,22 pH
- 2.23 Stabilitás
- 2.24 Reakciók
- 3 Összefoglalás
- 4 Felhasználások
- 5 Kockázatok
- 6 Referenciák
A ciklohexén szerkezete
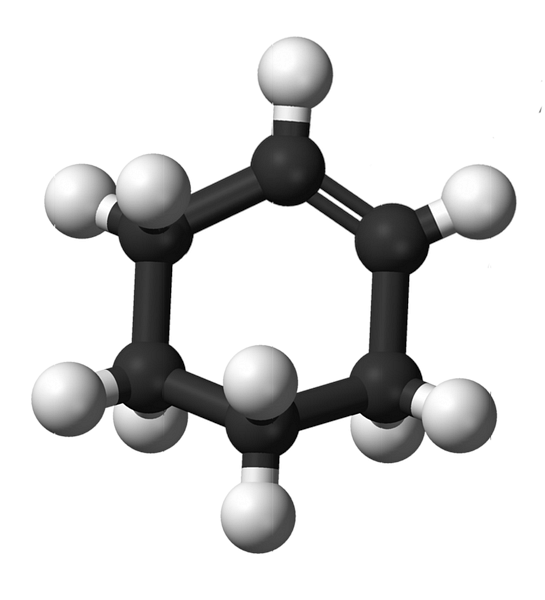
A ciklohexén szerkezete a gömbök és rudak modelljével a fenti képen látható. Megfigyelhetjük a hat széngyűrűt és a kettős kötést, mindkét vegyület telítetlenségét. Ebből a szempontból úgy tűnik, hogy a gyűrű sík; de egyáltalán nem.
Kezdők esetében a kettős kötés szénatomjai sp-hibridizálódnak2, amely trigonal sík geometriát ad. Ezért ezek a két szén és a szomszédosok ugyanabban a síkban vannak; míg a két szénatom a másik végén (a kettős kötéshez) az említett sík felett és alatt van.
Az alsó kép tökéletesen szemlélteti, amit éppen magyarázott.

Megjegyezzük, hogy a fekete sáv négy szénatomból áll: a kettős kötésből kettőből és a többi szomszédból. A kitett perspektíva az, ami akkor érhető el, ha a néző a szemét a kettős kötés előtt helyezné el. Akkor látható, hogy a szén ezen a síkon felül és alatt van.
Mivel a ciklohexénmolekula nem statikus, a két szénatom cserélődik: az egyik alacsonyabb lesz, míg a másik a sík fölé emelkedik. Tehát azt várnád, hogy a molekula viselkedjen.
Intermolekuláris kölcsönhatások
A ciklohexén szénhidrogén, ezért intermolekuláris kölcsönhatásai a londoni diszperziós erőkre épülnek..
Ez azért van így, mert a molekula apoláris, állandó dipol-pillanat nélkül, és a molekulatömege az a tényező, amely leginkább hozzájárul ahhoz, hogy a folyadékot összetartja..
A kettős kötés növeli az interakció mértékét, mivel nem tud ugyanolyan rugalmassággal mozogni, mint a többi szénatom, és ez kedvez a szomszédos molekulák közötti kölcsönhatásnak. Ezért van a ciklohexén kissé magasabb forráspontja (83 ° C), mint a ciklohexán (81 ° C)..
tulajdonságok
Kémiai nevek
Ciklohexén, tetrahidrobenzol.
Molekulatömeg
82,146 g / mol.
Fizikai megjelenés
Színtelen folyadék.
szag
Édes szag.
Forráspont
83 ° C és 760 mmHg között.
Olvadáspont
-103,5 ° C.
Gyújtási pont
-7ºC (zárt csésze).
Oldhatóság vízben
Gyakorlatilag oldhatatlan (213 mg / l).
Oldhatóság szerves oldószerekben
Az etanollal, benzollal, szén-tetrakloriddal, petroléterrel és acetonnal elegyedik. Várható, hogy képes lesz feloldani az apoláris vegyületeket, mint a szén összes allotropja.
sűrűség
0,810 g / cm33 20 ° C-on.
Gőzsűrűség
2.8 (a levegőhöz viszonyítva 1).
Gőznyomás
89 mmHg 25 ° C-on.
Öngyulladás
244 ° C.
bomlás
Uránsók jelenlétében bomlik, napfény és ultraibolya sugárzás hatására.
viszkozitás
0,625 mPascal 25 ° C-on.
Az égési hő
3,751,7 kJ / mol 25 ° C-on.
Párolgási hő
30,46 kJ / mol 25 ° C-on.
Felületi feszültség
26,26 mN / m.
polimerizáció
Polimerizálhat bizonyos körülmények között.
Szagküszöb
0,6 mg / m3.
Törésmutató
1,4465 ° C-on.
pH
7-8 ° C-on.
stabilitás
A ciklohexén nem tartósan stabil a hosszú távú tárolás során. A fény és a levegő kitettsége peroxidok termelését okozhatja. Hasonlóképpen, az összeférhetetlen az erős oxidálószerekkel.
reakciók
-A cikloalkének főként az elektrofil és a szabad gyökök addíciós reakcióit tapasztalják.
-Reagál brómmal, így 1,2-dibróm-ciklohexánt képez.
-Gyors kálium-permanganát (KMnO) jelenlétében gyorsan oxidálódik4).
-Képes egy epoxid (ciklohexén-oxid) előállítására peroxibenzoesav jelenlétében.
szintézis
A ciklohexént ciklohexanol savkatalízisével állítjuk elő:
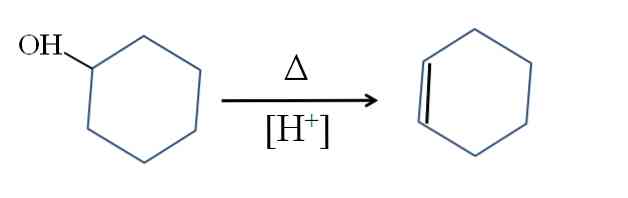
Az A szimbólum azt a hőt jelenti, amely szükséges ahhoz, hogy az OH-csoport vízmolekulaként történő kilépését elősegítsük savas közegben (-OH2+).
A ciklohexént benzol részleges hidrogénezésével is előállítjuk; vagyis kettő kettőskötése hidrogénmolekulát ad:
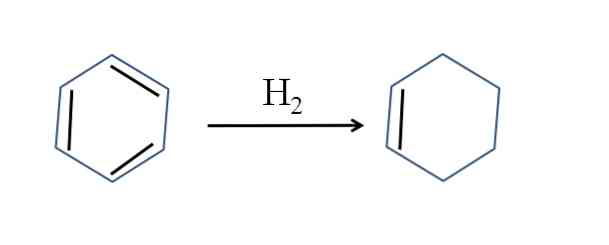
Bár a reakció egyszerűnek tűnik, nagy nyomást igényel H2 és katalizátorok.
alkalmazások
-Alkalmas szerves oldószerként. Ezenkívül az adipinsav, az adipinsav, a maleinsav, a ciklohexán és a ciklohexil-karbonsav előállítására szolgáló nyersanyag..
-Ciklohexán-klorid előállítására használják, amelyet a gyógyszeripari termékek és a gumi adalékanyagok gyártásánál használnak..
-A ciklohexént a ciklohexanon, a gyógyszerek, peszticidek, parfümök és színezékek előállítására szolgáló nyersanyag szintézisében is használják..
-A ciklohexén részt vesz az amino-ciklohexanol, egy felületaktív anyagként és emulgeálószerként használt vegyület szintézisében..
-Ezenkívül a butadién laboratóriumában a ciklohexén alkalmazható. Az utóbbi vegyületet szintetikus gumi gyártására használják, gépkocsik gumiabroncsainak gyártásához, és akril műanyag gyártásához is használják..
-A ciklohexén a lizin, fenol, polycycloolefin gyanta és gumi adalékanyagok szintézisének alapanyaga..
-Magas oktánszámú gázolajok stabilizátoraként használják.
-Részt vesz a vízálló bevonatok, repedésálló filmek és kötőanyagok kötőanyagainak szintézisében.
kockázatok
A ciklohexén nem egy nagyon mérgező vegyület, de érintkezéskor a bőr és a szemek bőrpírját okozhatja. Belélegzése köhögést és álmosságot okozhat. Ezen túlmenően, lenyelése álmosságot, légzési nehézséget és hányingert okozhat.
A ciklohexén gyengén felszívódik a gyomor-bél traktusban, így a lenyelés miatt nem várható komoly szisztémás hatás. A legnagyobb szövődmény a légzőrendszer által okozott aspiráció, amely kémiai tüdőgyulladást okozhat.
referenciák
- Joseph F. Chiang és Simon Harvey Bauer. (1968). A ciklohexén molekuláris szerkezete. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Ciklohexén: veszélyek, szintézis és szerkezet. Tanulmány. Visszaváltva: study.com
- Morrison, R. T. és Boyd, R. N. (1987). Szerves kémia (5ta Kiadás.). Szerkesztői Addison-Wesley Iberoamericana.
- Pubchem. (2019). Ciklohexénoxidot. Lap forrása: pubchem.ncbi.nlm.nih.gov
- Vegyi könyv. (2019). Ciklohexénoxidot. A lap eredeti címe: chemicalbook.com
- Toxikológiai adathálózat. (2017). Ciklohexénoxidot. TOXNET. Visszavont: toxnet.nlm.nih.gov
- Chemoxy. (N.d.). A ciklohexén szerkezeti képlete a. A lap eredeti címe: chemoxy.com


