Nátrium-szulfát formula, tulajdonságok, szerkezet, alkalmazások
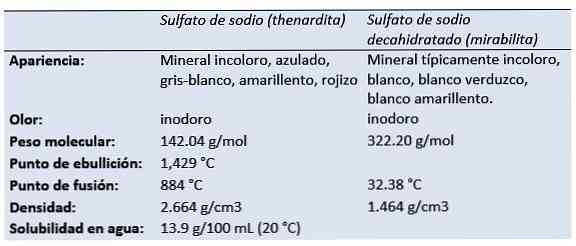
az nátrium-szulfát (a kénsav dinátrium-sója, dinátrium-tetraoxidoszulfát, szóda-szulfát, Glauber-só, majd a szulfát, a mirabilit) a Na-szervetlen vegyület.2SW4 és a kapcsolódó hidrátok. Minden forma fehér szilárd anyag, amely vízben nagyon jól oldódik.
A forgalmazott egyik fő vegyipari terméknek tekinthető. Világszerte gyártása (szinte kizárólag dekahidrát formájában) évente körülbelül 6 millió tonna.

Ezután a vízmentes nátrium-szulfát ásványi anyag, amely száraz, párologtatott környezetben, száraz barlangokban, régi bányászati műveletekben keletkezik, mint virágzás, és fumarolok körüli letétként..
Először 1825-ben írták le Salinas Espartinasban (Ciempozuelos, Madrid, Spanyolország), majd a francia kémikus, Louis Jacques Thénard (1777-1826) tiszteletére nevezték..

A holland / német kémikus és Johann Rudolf Glauber (1604-1670) 1625-ben egy osztrák tavaszi vízben fedezte fel a nátrium-szulfát-dekahidrátot (később Glauber-só néven). Mirabilis sót (csodálatos sót) nevezte gyógyászati tulajdonságainak köszönhetően.
1650 és 1660 között Glauber elkezdte nátrium-szulfát gyártását közönséges sóból (NaCl) és tömény kénsavból. Ez a folyamat a vegyipar kezdetének tekinthető.
A kristályokat hashajtóként használták a 20. századig.
A XVIII. Században a Glauber-só és a kálium-karbonát sójának (nátrium-karbonát) ipari termeléséhez használt reakciót alkalmazták..

Jelenleg elsősorban mosó- és tisztítószerek gyártására és a papírpép előállítására szolgáló Kraft-eljárásban használják (a papírgyártás domináns módszere)..
A nátrium-szulfát ásványi lerakódások az Egyesült Államokban, Kanadában, Spanyolországban, Olaszországban, Törökországban, Romániában, Mexikóban, Botswanában, Kínában, Egyiptomban, Mongóliában és Dél-Afrikában találhatók..
A fő termelők Kína (Jiangsu és Sichuan tartományok), amelyet Spanyolország követ, ahol a világ legnagyobb glauberit betétje található (Cerezo de Río Tirón, Burgos).
A természetes nátrium-szulfát teljes világtermelését körülbelül 8 millió tonnára becsülik, és azt, amit más ipari folyamatok melléktermékeiből nyertek 2 és 4 Mt között..
Spanyolországban a Nátrium-szulfát-források nemzeti nyilvántartásában közzétett információk és egyéb frissített adatok szerint a nátrium-szulfát ásványi anyagok becsült készletei „tartalékként” 730 Mt, és 300 millió tonna „egyéb erőforrásként” szerepelnek..
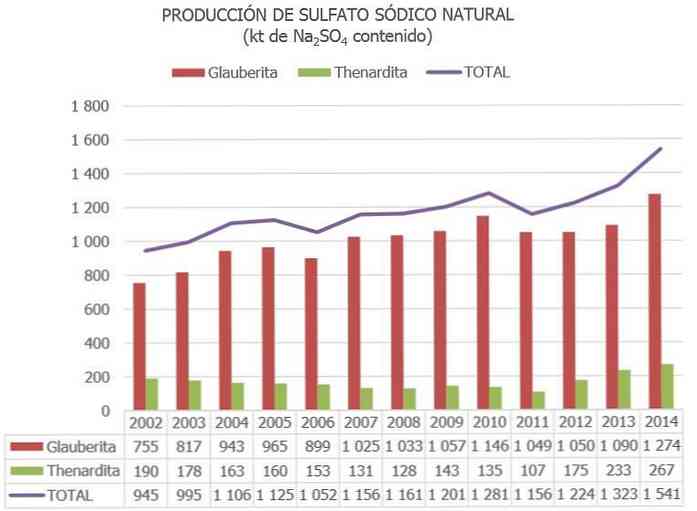
Az Európai Unióban Spanyolország jelenleg az egyetlen ország, ahol a nátrium-szulfát ércje van (főként a Sardardit, Glauberit és Mirabilite)..
Jelenleg a textiliparban általában csökken a nátrium-szulfát iránti kereslet.
Az elmúlt években más ágazatokban, például a mosó- és tisztítószerekben, bizonyos régiókban az alacsony nyersanyagár miatt növekedett.
A nátrium-szulfát tisztítószerek főbb bővülő piacai Ázsiában, Közép-Amerikában és Dél-Amerikában találhatók.
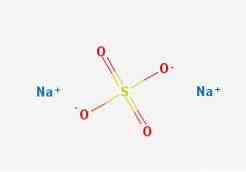
képletek

2D szerkezet
3D szerkezet
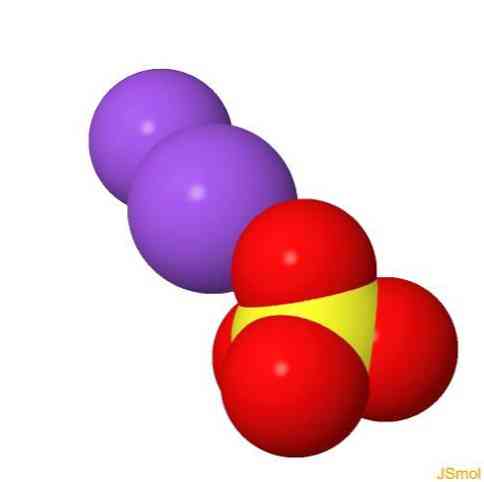
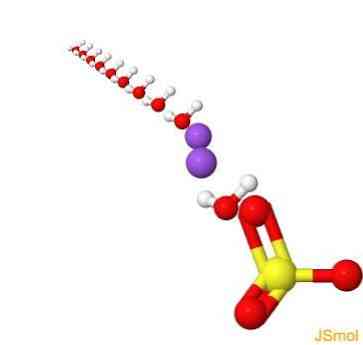
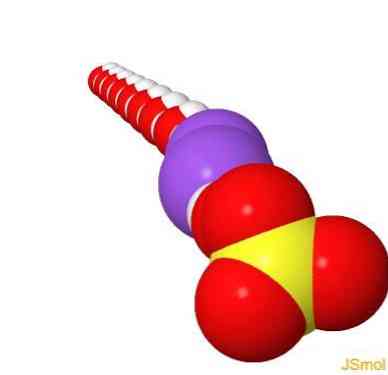
jellemzői
Fizikai és kémiai tulajdonságok
A nátrium-szulfát a nátrium-vegyületek reakcióképes csoportjába tartozik, és a szulfátok, hidrogénszulfátok és diszulfitok csoportjába tartozik..
gyúlékonyság
Nem éghető anyag. A porok robbanásveszélye nincs.
reakcióképesség
A nátrium-szulfát vízben nagyon jól oldódik és higroszkópos. Nagyon stabil, normál hőmérsékleten nem reagál a legtöbb oxidáló vagy redukálószerre. Magas hőmérsékleten karbotermikus redukcióval nátrium-szulfiddá alakítható.
A kémiailag nem reakcióképes anyagok tipikus környezeti körülmények között nem reaktívnak tekinthetők (bár viszonylag szélsőséges körülmények között vagy katalízisben is reagálhatnak). Ezek ellenállnak az oxidációnak és a redukciónak (kivéve extrém körülmények között).
Veszélyes kémiai reakciók
Ha az alumíniumot nátrium- vagy kálium-szulfáttal megolvasztják, erőszakos robbanás lép fel.
toxicitás
A kémiailag nem reaktív anyagokat nem mérgezőnek tekintik (bár ebből a csoportból származó gázok asphyxianként működhetnek).
Bár a nátrium-szulfátot általában nem toxikusnak tekintik, óvatosan kell kezelni. A por asztmat vagy ideiglenes szemirritációt okozhat. Ezt a kockázatot elkerülheti a szemvédő és a papírmaszk viselése.
alkalmazások
Fő alkalmazási területei:
- mosószer por.
- papírpép.
- textíliák.
- üveg.
- enzimek szintézise (borkészítés).
- emberi és állati élelmiszerek.
- gyógyszertári termékek.
- általános kémia.
- acél folyamatok.
- Mosószer por
A nátrium-szulfát nagyon olcsó anyag. Legnagyobb felhasználása a háztartási porított mosószerek töltőanyagaként, kb. A világ termelésének 50% -a. Az új, kompakt vagy folyékony mosószerek nem tartalmaznak nátrium-szulfátot, így ez a felhasználás csökken.
Egy másik fontos nátrium-szulfát alkalmazása, különösen az USA-ban. és Kanadában, a Kraft folyamatban van a cellulóz gyártására. Az eljárás termikus hatékonyságának előrehaladása drasztikusan csökkentette a nátrium-szulfát szükségességét.
Az üvegipar további fontos alkalmazást jelent a nátrium-szulfát számára. Ez a második legnagyobb alkalmazás Európában. A nátrium-szulfátot az olvadt üvegből származó kis légbuborékok kiküszöbölésére használják.
Japánban a nátrium-szulfát legnagyobb alkalmazási területe a textíliák gyártása. A nátrium-szulfát segít a színezékek egyenletes behatolásában a szálakba, és nem korrodálja a festés során használt rozsdamentes acél edényeket (a nátrium-kloriddal ellentétben, ami az alternatív módszer).
A nátrium-szulfát különösen alkalmas alacsony minőségű napenergia-hő tárolására (a későbbi fűtési alkalmazásokhoz), mivel fűtőanyag-változása során a hőmennyiséget szilárd anyagból folyadékba emelik, ami 32 ° C-on van megadva..
Hűtés esetén a nátrium-klorid (NaCl) közönséges só keveréke az olvadáspontot 18 ° C-ra csökkenti.
A laboratóriumban a vízmentes nátrium-szulfátot széles körben használják közömbös szárítószerként, a szerves oldatokból származó víznyomok eltávolítására. Hatása lassabb, mint a magnézium-szulfáté, de sokféle anyaggal használható, mivel kémiailag eléggé inert.
A nátrium-szulfát-dekahidrátot (Glauber-só) történelmileg hashajtóként alkalmazták. A túladagolás után hatásos bizonyos gyógyszerek, például az acetaminofen (acetaminofen) eltávolítására a szervezetből..
A nátrium-szulfát egyéb alkalmazási területei közé tartozik, hogy adalékanyagként használják szőnyeglevegők, mint állati takarmány adalékanyagaként és keményítő gyártásában..
Klinikai hatások
Terápiás alkalmazásukhoz a nátrium-szulfát a székrekedés és a székrekedés kezelésére alkalmazott katartikus hashajtók közé tartozik..
A sós katartikumok olyan sók, amelyek megtartják a bélben a nem felszívódó só ozmotikus hatásával a folyadékokat, és közvetett módon növelik a perisztaltikát..
A sós katartikumok gyengén felszívódnak a gyomor-bélrendszerben, ezért a szisztémás toxicitás valószínűtlen, kivéve, ha hatalmas mennyiségeket fogyasztanak. Azonban a nagy expozíció dehidratációt és elektrolitváltozásokat okozhat, amelyek a vegyület ozmotikus hatásaihoz képest másodlagosak.
Krónikus hashajtó visszaélés fordulhat elő étkezési zavarokkal, Munchausen szindrómával vagy tényszerű rendellenességekkel rendelkező betegeknél. A betegek általában hányingert, hányást és hasmenést tapasztaltak a hasi görcsökkel. A súlyos hatások közé tartozik a dehidratáció, a hypotonia, a hypernatremia és az elektrolit rendellenességek.
Biztonság és kockázatok
A vegyi anyagok osztályozására és címkézésére szolgáló globálisan harmonizált rendszer veszélyességi nyilatkozatai (SGA).
A vegyi anyagok osztályozásának és címkézésének globálisan harmonizált rendszere (SGA) egy nemzetközileg elfogadott rendszer, amelyet az Egyesült Nemzetek Szervezete (ENSZ) hoz létre, amely a különböző országokban alkalmazott különböző besorolási és címkézési szabványok helyettesítésére szolgál az egységes globális kritériumok alkalmazásával (ENSZ). United, 2015).
A veszélyességi osztályok (és a GHS megfelelő fejezete), a besorolási és címkézési előírások, valamint a nátrium-szulfátra vonatkozó ajánlások a következők (Európai Vegyianyag-ügynökség, 2017, Egyesült Nemzetek, 2015, PubChem, 2017):
A GHS veszélyességi osztályai
H315: Bőrirritációt okoz [Figyelmeztetés Bőrkorrózió / irritáció - 2. kategória].
H317: Allergiás bőrreakciót okozhat [Figyelmeztetés érzékenyítés, bőr - 1. kategória].
H319: Súlyos szemirritációt okoz [Figyelem Súlyos szemkárosodást / szemirritációt - 2.A kategória].
H412: Ártalmas a vízi szervezetekre, hosszan tartó káros hatásokkal [Vízi környezetre veszélyes, hosszú távú veszély - 3. kategória].
(PubChem, 2017)
A prudenciális tanácsok kódjai
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 és P501.
referenciák
- ChemIDplus (2017) 3D-s szerkezet 7757-82-6 - vízmentes nátrium-szulfát [kép]. A lap eredeti címe: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-s szerkezet 7727-73-3 - Nátrium-szulfát [USP] [image]. A lap eredeti címe: chem.nlm.nih.gov.
- Dyet, D. (2007) Thenardite nátrium-szulfát a Sodaville-i ásványi megye közelében Nevada [image] A lap eredeti címe: en.wikipedia.org.
- Európai Vegyianyag-ügynökség (ECHA), (2017). A besorolás és a címkézés összefoglalása. Harmonizált osztályozás - az 1272/2008 / EK rendelet VI. Melléklete (CLP-rendelet). Nátrium-szulfát.
- Grumetisho (2012) Mirabilita [image] A lap eredeti címe: es.wikipedia.org.
- Veszélyes anyagok adatbankja (HSDB). TOXNET. (2017). Nátrium-szulfát Bethesda, MD, EU: Nemzeti Orvostudományi Könyvtár. Visszavont: toxnet.nlm.nih.gov.
- Spanyolország Földtani és Bányászati Intézete (IGME) (2016). GLAUBERITA-THENARDITA (NATURAL SODIUM SULPHATE) 2014. Bányászati panoráma. Lap forrása: igme.es.
- Nemzeti Munkahelyi Biztonsági Intézet (INSHT). (2010). Nemzetközi biztonsági vegyi nyilvántartások. Nátrium-szulfát. Munkaügyi és Biztonsági Minisztérium. Madrid. Az is. A lap eredeti címe: insht.es.
- Langbein Rise (2008) Folyamatos kraft cellulóz mil [image] A lap eredeti címe: wikimedia.org.
- Egyesült Nemzetek Szervezete (2015). Globálisan harmonizált rendszer a vegyi termékek osztályozására és címkézésére (SGA) Hatodik módosított kiadás. New York, Egyesült Államok: Egyesült Nemzetek kiadványa. Lap forrása: unece.org.
- Nemzeti Biotechnológiai Információs Központ. PubChem Compound adatbázis (2016) nátrium-szulfát - PubChem szerkezet [image] Bethesda, MD, EU: Nemzeti Orvostudományi Könyvtár. Lap forrása: pubchem.ncbi.nlm.nih.gov.
- Nemzeti Biotechnológiai Információs Központ. PubChem Compound adatbázis (2016) nátrium-szulfát - PubChem szerkezet [image] Bethesda, MD, EU: Nemzeti Orvostudományi Könyvtár.
- Nemzeti Biotechnológiai Információs Központ. PubChem összetett adatbázis. (2017). Dekahidrált nátrium-szulfát. Bethesda, MD, EU: Nemzeti Orvostudományi Könyvtár. Lap forrása: pubchem.ncbi.nlm.nih.gov.
- Nemzeti Biotechnológiai Információs Központ. PubChem összetett adatbázis. (2017). Nátrium-szulfát Bethesda, MD, EU: Nemzeti Orvostudományi Könyvtár. Lap forrása: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Nátrium-szulfát [image] A lap eredeti címe: wikimedia.org.
- Wikipedia (2017) Kraft folyamat. A lap eredeti címe: wikipedia.org.
- Wikipedia (2017) Mirabilita. A lap eredeti címe: wikipedia.org.
- Wikipedia (2017) Mirabilite. A lap eredeti címe: wikipedia.org.
- Wikipedia (2017) Nátrium-szulfát. A lap eredeti címe: wikipedia.org.
- Wikipedia (2017) Solfato di nátrium decaidrate. A lap eredeti címe: https://it.wikipedia.org.
- Wikipedia (2017) Nátrium-szulfát. A lap eredeti címe: wikipedia.org.
- Wikipédia (2017) Thenardita. A lap eredeti címe: wikipedia.org.
- Wikipédia (2017) Thenardite. Lap forrása: .wikipedia.org.


